
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оценка энергии ионной связи.
Для количественного описания ионной связи введем два понятия: энергия (потенциал) ионизации и энергия сродства к электрону.
Энергией ионизации (I) называется количество энергии, необходимое для отрыва электрона от нейтрального атома или иона при условии, что частица находится в основном состоянии. Значения энергии ионизации, выраженные в эВ и численно равны потенциалам ионизации в В.
Сродством к электрону (Еср.) называется количество энергии (выделяемой или поглощаемой) в результате присоединения электрона к частице (атому или отрицательно заряженному иону), находящейся в основном состоянии.
В качестве примера рассмотрим возможность образования ионной молекулы из первоначально изолированных атомов Сs (имеющего минимальное значение энергии ионизации из всех известных элементов) и Сl (максимальное значение сродства к электрону). Разобъем процесс на ряд этапов:
а) ионизация атома Сs (отрыв электрона с 6s-орбитали)
Cs – e- → Cs+ – 374 кДж ⁄ моль (Q = –I)
б) присоединение электрона к атому Сl на Зр-орбиталь
Сl + e- → Cl– + 361,9 кДж ⁄ моль (Q = Еср)
Тогда Qобщ. = –374 + 361,9 = –12,1 кДж⁄моль, т.е. система из двух изолированных атомов более стабильна, по сравнению с системой из 2-х изолированных ионов.
в) возникновение силы притяжения между ионами, которая в соответствии с законом Кулона понижает потенциальную энергию системы (при этом ионы рассматриваются как недеформированные шары с зарядами z1 и z2):
| DUпр. = – | NА z1 z2 е2 | (1.2) |
| r |
где NА - число Авогадро, е - заряд электрона, z1 и z2 – модули зарядов ионов, r - расстояние между ионами.
Обычно межионные расстояния измеряются в ангстремах (1 Å = 10-8 см). Если расстояние между ионами измерено в этих единицах, то уравнение (1) для однозарядных ионов имеет следующий вид:
DUпр. =– 1391,5 / r (кДж ⁄ моль)
Следовательно, для межионных расстояний менее 114,7 Å эта кулоновская стабилизация достаточна для образования ионной пары Сs+–Сl– с более низкой энергией по сравнению с изолированными атомами. Для других систем это максимальное расстояние значительно меньше, например 10,6 Å для ионной пары Nа+–Сl–. В тоже время по мере сближения ионов (уменьшение r) стабилизация системы должна возрастать. Но при этом одновременно с ростом силы притяжения увеличиваются и силы отталкивания между частицами, обусловленные как электростатическим межэлектронным отталкиванием, так и «силами Паули» (при сближении двух ионов с заполненными электронными оболочками принцип Паули запрещает электронам располагаться на уже занятых орбиталях, что приводит к увеличению энергии системы и фиксируется как отталкивание). При очень малых значениях r существенный вклад в силы отталкивания дает и межядерное кулоновское взаимодействие. В первом приближении энергию отталкивания можно принять обратно пропорциональной расстоянию между ионами (r) в степени, равной коэффициенту борновского отталкивания (n):
DUот. = 1/ rn (кДж ⁄ моль) (2.2)
Величина борновского отталкивания иона зависит от его природы, электронной конфигурации и, как правило, принимает значения от 5 до 12. Значения n для ионных соединений равны усредненному значению n для компонентов. Например, для хлорида натрия n = 8, а для хлорида калия n = 9.
Графически зависимости энергий отталкивания и притяжения от межядерного расстояния представлены на рис.1.2 (кривая 1 и 2 соответственно). Суммарное изменение энергии в системе в зависимости от r показывает кривая 3. Как видно из рис.1.2, на определённом расстоянии между ионами (rо) энергия в системе достигает минимума, что предопределяет максимальную устойчивость ионной пары.
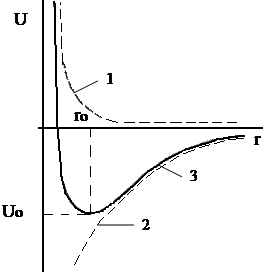
Рисунок 1.2 – Зависимости энергий отталкивания (кривая 1), притяжения (кривая 2) и суммарной энергии (кривая 3) от межядерного расстояния (r).
Таким образом, rо - длина химической связи в ионной молекуле, а величина Uо характеризует энергию образования молекулы из изолированных ионов. Полная же энергия взаимодействия двух ионов, находящихся на расстоянии ro, равна сумме энергий притяжения и отталкивания и для 1 моля молекул может быть определена уравнением:
| DUпр. = – | NА z1 z2 е2 | (1 – | 1/n) | (3.2) |
| ro |
Рассмотрим процесс образования ионной молекулы NaCl из атомов (в
3 стадии):
Na – 1 e- ® Na+ – I1 (Q1 = – I1)
Cl + 1 e- ® Cl– + Eср (Q2 = Еср)
Na+ + Cl– → NaCl – DUпр. (DUпр. = –Q3)
Na + Cl → NaCl + Q ,
где Q – тепловой эффект реакции образования молекулы NaCl из атомов.
Тогда Q = – I1 + Eср – DUпр. (4.2)
Так как условием образования ионной молекулы из атомов можно считать неравенство Q>0, то из уравнения (4.4) видно, что для образования ионной молекулы необходимо выполнение неравенства (DUпр.)>(–I1+Еср) (как было показано выше (–I1+Еср)<0 и DUпр.<0), что выполняется, если один из «партнёров» по реакции имеет низкий потенциал ионизации, а второй высокую энергию сродства к электрону.
Следует отметить, что в общем случае не очевидно, что образуется из атомов А и В – молекула А+В– или А–В+. Исходя из уравнения (4) получим для А+В–:
Q1 = – IA + E срВ – DUпр.'
и для А–В+:
Q2 = – IB + EсрА – DUпр."
С точки зрения принципа наименьшей энергии произойдет образование той молекулы, для которой Q более положительная величина. Если считать, что ro в обеих молекулах А+В– и А–В+, одинаково, то согласно уравнению (1) U0' = U0", тогда:
Q1 – Q2 = – IA + EсрВ + IВ – ЕсрА = (IВ + EсрВ) – (IA + EсрА) = хА – хВ,
где хА, хВ - электроотрицательности А и В соответственно. Понятие электроотрицательности впервые введено Малликеном в 1935 г. как сумма ионизационного потенциала атома и его сродства к электрону (х = I + Еср.).
В рассмотренном примере при хА>хв, Q1<Q2, т.е. образуется молекула А–В+, в противоположном случае (когда хА<хВ) – молекула А+В–. Таким образом, при образовании ионной молекулы более электроотрицательный атом превращается в анион, а менее электроотрицательный – в катион.
В общем случае (независимо от типа химической связи) электроотрицательность показывает способность атома данного элемента смещать на себя электронную плотность химической связи и поэтому с помощью разности электроотрицательностей можно в первом приближении оценить полярность химической связи.
В настоящее время существует около 20 шкал электроотрицательности, в основу расчета которых положены различные свойства веществ и атомов их образующих. Например, согласно Полингу, рассматривается вклад электростатического взаимодействия в общую энергию химической связи, Олрид и Рокау определяют электроотрицательность как силу притяжения между атомом и электроном, удаленным от ядра на ковалентный радиус и т.д.
В связи с этим значения электроотрицательности разных шкал отличаются между собой, но относительное расположение элементов в рядах электроотрицательностей примерно одинаково: наименьшими значениями электроотрицательности характеризуются s-элементы главных подгрупп I и II группы, а наибольшей - р-элементы главной подгруппы VII группы, а также 0, N, S, С, Sе. Однако, используя понятие электроотрицательности, следует помнить, что это не однозначная физическая величина, которая может быть измерена экспериментально. Строго говоря, элементу нельзя приписать постоянную электроотрицательность, т.к. она зависит от многих факторов, в частности от числа химических связей в соединении, числа и природы атомов партнеров, геометрии многоатомных частиц и т.д. Тем не менее, это понятие может быть использовано для качественного объяснения ряда свойств химической связи, с ее помощью определяются знаки степеней окисления элементов и оцениваются некоторые свойства соединений.
Дата добавления: 2014-11-13; просмотров: 452; Мы поможем в написании вашей работы!; Нарушение авторских прав |