
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сродства к электрону
Сродством к электрону (Еē) называют энергетический эффект присоединения дополнительного электрона на валентную орбиталь изолированного (газообразного) атома:
 .
.
В большинстве случаев данный процесс идет самопроизвольно и при этом по давно сложившейся традиции энергии сродства приписывают положительный знак. Отрицательное сродство к электрону имеют лишь атомы с устойчивыми электронными конфигурациями: полузаполненными и полностью заполненными подуровнями (напомним, что такие атомы очень стабильны к изменению своей электронной конфигурации, в частности, имеют завышенные энергии ионизации – см. рис. 1.16). Но именно в отношении к этим элементам и только к ним применима хорошо известная многим школьникам фраза, что каким-то атомам (в качестве примера, обычно, называют кислород и галогены) "гораздо выгодней присоединить дополнительный электрон, чем потерять собственный". Так вот, потеря электрона никогда не проходит "с выгодой", – это всегда эндотермические процессы. Причем для ионизации, скажем, атомов бериллия, азота и неона действительно требуются большие затраты энергии, чем на присоединение дополнительного электрона к ним. Все прочие элементы второго периода присоединяют электрон экзотермично.
Прежде, чем приступать к анализу закономерностей изменения Еē, отметим, что определить смысл сродства к электрону можно и иначе: это энергия, которую необходимо затратить (ряде случаев она выделяется) удаления электрона из газообразного однозарядного аниона:


| Рис. 1.22 – Изменение первой энергии ионизации, сродства к электрону и электроотрицательности (найденной по первоначальной, упрощенной модели Малликена) для элементов II–го и III–го периодов периодической системы. |
Теперь несложно сделать несколько важных обобщающих выводов:
ü Сродство к электрону зависит от тех же факторов, что и энергии ионизации (см. стр.65), но, поскольку в анионах Э–на один электрон больше, чем в нейтральных атомах, то схемы изменения I1 и Еē напоминают друг друга со сдвижкой на один элемент.
ü Для любого атома всегда |Еē| < |I1|, т.к. появление дополнительного электрона увеличивает эффект экранирования заряда ядра. Причем по периоду роль зарядового электрона в межэлектронном отталкивании должна повышаться из-за уменьшения размера электронного облака. Как следствие в целом растет разница между I1 и Еē (рис.1.22). В более крупных атомах III-го и последующих периодов, с одной стороны, растущий заряд ядра не так сильно стабилизирует некайносимметричные 3р–, 4р–… орбитали (I1 увеличиваются медленней), а, с другой, – в более крупных атомах 3р–, 4р–… элементов вклад дополнительного электрона в межэлектронное отталкивание будет выражен слабей, поэтому первые 3р–элементы (Na, Mg) имеют более низкое сродство к электрону, чем Li и Be, а последние (например, S, Cl) присоединяют электрон лучше, чем О и F, соответственно.
ü В подгруппах электронные конфигурации Э–сохраняются неизменными, поэтому сродство к электрону меняется в соответствие с растущим орбитальным радиусом, который, в свою очередь, формируется с учетом заряда ядра и эффектов экранирования и проникновения (zэфф) валентных электронов. В то же время, для р–элементов второго периода постепенно усиливается вклад зарядового электрона в межэлектронное отталкивание, поэтому их сродство к электрону постепенно становится все более низким по сравнению с элементами III-го преиода (рис.1.22).
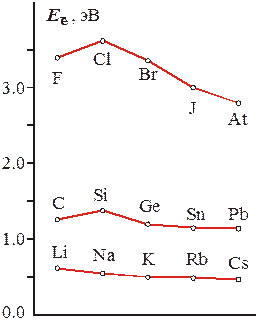
| Рис. 1.23 – Изменение сродства к электрону в некоторых главных подгруппах периодической системы. |
При этом у крупных атомов больших периодов сродство к электрону оказывается настолько низким, что их абсолютные значения могут найдены только с большими погрешностями.
В заключение отметим, что сродство ко второму электрону не представляет особого интереса, т.к. сближение одноименно заряженных
 .
.
частиц никогда не происходит самопроизвольно. Двухзарядные одноатомные ионы (как катионы, так и анионы) могут быть стабилизированы только в составе ионных кристаллов за счет энергии кристаллической решетки или в растворах за счет энергии сольватации.
Дата добавления: 2014-11-13; просмотров: 646; Мы поможем в написании вашей работы!; Нарушение авторских прав |