
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Атомных орбиталей
Применяя законы термодинамики, следует ожидать, что при низких температурах электроны будут самопроизвольно заселять АО с минимальной энергией (принцип минимума энергии для основного состояния атома). Как было показано ранее (стр.23), точно определить энергию АО в многоэлектронном атоме невозможно, но, поскольку энергия электрона зависит от главного и орбитального квантовых чисел, то были предложены эмпирические правила, которые позволяют сравнить энергии АО, не рассчитывая их (правила В.Клечковского):
· минимальную энергию имеет атомная орбиталь с минимальной суммой n+l;
· если для нескольких атомных орбиталей эта сумма совпадает, то меньшую энергию имеет орбиталь с меньшим значением главного квантового числа n.
Применим эти правила для сравнения атомных орбиталей первых четырех энергетических уровней.
Как видно из таблицы 1.4, в первых двух энергетических уровнях энергия атомных орбиталей меняется достаточно просто. А вот затем в конкуренцию с орбиталями третьего энергетического уровня "включается" 4s–орбиталь. Применяя правила В.Клечковского, нетрудно понять, что 4d– и 4f–орбитали реально имеют более высокую энергию, чем некоторые орбитали пятого и даже шестого энергетического уровня! (не приведены в таблице и на энергетической схеме). Все это косвенно указывает на то, что постепенно уменьшается разница между разными уровнями, но одновременно
Таблица 1.4
Применение правил Клечковского
для определения порядка заселения АО электронами
| Номер энергетического уровня | Название АО | n | l | n + l | Очередность заселения АО |
| первый | 1s | ||||
| второй | 2s 2рx;2py;2pz | ||||
| третий | 3s 3рx;3py;3pz 3dxy; 3dxz; 3dyz; 3dx2–y2; 3dz2 | ||||
| четвертый | 4s 4р–орбитали 4d–орбитали 4f–орбитали | 13/14 |

усиливается энергетическая разницамеждуподуровнями, особенно между р– и d–орбиталями (d– и f–орбиталями) одного энергетического уровня.

Следующим важным правилом, определяющим электронное строение атомов, является принцип или запрет В.Паули:
· в атоме не может быть даже двух электронов с одинаковым набором всех четырех квантовых чисел.
Обоснование принципа В.Паули выходит за рамки данного пособия, но следует иметь в виду, что данное утверждение является абсолютно категоричным, не допускающим исключения.
Из запрета В.Паули следует, что на каждой атомной орбитали может "находиться" на более двух электронов с противоположными по знаку спиновыми квантовыми числами.[2] Такие электроны называют спаренными, в отличие от одиночных (неспаренных) электронов. Часто при
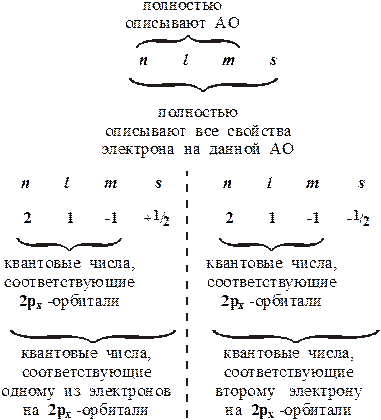 |
анализе электронного строения упоминаются и "пустые АО". Справедливость следствия из принципа В.Паули можно продемонстрировать, если, например, рассмотреть какие квантовые числа описывают движение электронов на 2рx-орбитали:
Схематично орбитали и электроны на них изображают следующим образом:

Применение принципа минимума энергии и принципа В.Паули позволяет правильно заселить только 1s- и 2s-орбитали, т.к. следом за ними по энергии идут три орбитали 2р-подуровня, которые различаются только взаимным расположением в пространстве. Очередность их заполнения определяется правилом В.Хунда:
· орбитали одного энергетического подуровня заселяются электронами так, чтобы абсолютное значение (модуль) суммы спиновых чисел был максимальным.
Т.е. подразумевается, что поначалу все 2р-орбитали равноправны (равновыгодны) и первый электрон может быть размещен на любой из них (спиновое квантовое число может быть произвольным):

Следующий электрон из-за межэлектронного отталкивания "будет располагаться" на одной из двух вакантных орбиталей (будет создавать собственное электронное облако), причем спиновые квантовые числа двух электронов должны совпадать:

Для размещения трех электронов на р-орбиталях имеется только два энергетически выгодных варианта:

В обоих случаях модуль суммы спиновых квантовых чисел составляет 3/2. При этом все три орбитали вновь становятся абсолютно равноправными, и четвертый электрон может быть размещен на любой из них. Для соблюдения принципа В.Паули требуется, чтобы спиновые квантовые числа электронов на одной орбитали были различны, например:
 .
.
Из-за особых межэлектронных взаимодействий повышенной устойчивостью отличаются электронные конфигурации с полузаполненными и полностью заполненными орбиталями одного подуровня: p3, p6, d5, d10 и т.п. Ради достижения таких состояний, как мы увидим позднее, порой происходят, так называемые, "электронные провалы" или "электронные проскоки" между близкими по энергии (n-1)d– иns–орбиталями (например, между 3d– и 4s–орбиталями в атомах хрома и меди).
Дата добавления: 2014-11-13; просмотров: 511; Мы поможем в написании вашей работы!; Нарушение авторских прав |