
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структуры периодической системы элементов
Основным состоянием атома называют такое, когда его электронное строение удовлетворяет всем выше разобранным правилам. Если атому (электрону) сообщить некоторую дополнительную энергию, то могут быть преодолены (нарушены) или принцип минимума энергии или правило В.Хунда. При этом атом переходит в возбужденное состояние. Стабильно существовать в таком состоянии атом не может и быстро опять понижает свою энергию или, возвращаясь в основное состояние, или устанавливая химические связи с другими атомами (чуть позднее мы убедимся, что химическая связь обязательно предполагает понижение энергии, установление связи – экзотермический процесс).
Наиболее простое электронное строение имеет атом водорода. Порядковый номер элемента Н свидетельствует о том, что заряд ядра атома водорода равен +1. Следовательно, в нейтральном атоме водорода имеется один единственный электрон. Он располагается на 1s-орбитали:
электронная формула атома Н – 1s1, схема заселения орбиталей –  .
.
Следующий за водородом элемент гелий имеет два электрона в нейтральном атоме. Оба они в соответствии с принципом В.Паули заселяют 1s-орбиталь:
электронная формула Не – 1s2, схема заселения орбиталей –  .
.
В атомах Н и Не идет последовательное заселение 1s–орбитали, поэтому их называют 1s-элементами. В атоме гелия завершается заполнение первого энергетического уровня, а сам элемент гелий замыкает первый период периодической системы.
Во втором периоде расположены восемь элементов: возглавляют его два 2s-элемента (Li, Ве), за ними располагаются 2р-элементы (B…Ne) – в этих элементах идет последовательное заселение 2р-орбиталей.
Разберем электронное строение некоторых элементов II-го периода.
· Например, порядковый номер атома бора равен пяти, следовательно Zядра(В) = +5 и в нейтральном атоме бора имеется пять электронов. У атомов II-го периода они располагаются на двух энергетических уровнях. Второй уровень для атома В будет внешним, валентным. Именно орбитали и электроны II-го уровня будут способны участвовать в связывании и другими атомами. На орбиталях II-го уровня в атоме бора имеется три электрона (см. номер группы):
N = 5, Zядра = 5, электронная формула атома В –  .
.
· В атоме азота семь электронов, из них пять находятся на орбиталях второго энергетического уровня:
N = 7, Zядра = 7, электронная формула атома N – 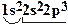 .
.
· В атоме неона десять электронов:
N = 10, Zядра = 10, электронная формула атома Nе –  .
.
Схема заселения атомных орбиталей, учитывая их разницу в энергиях, будет выглядеть следующим образом:

Из этих энергетических схем можно сделать несколько выводов:
ü Самый простой: 1s-орбиталь существенно отличается по энергии от орбиталей II-го энергетического уровня, т.е. 1s-электроны гораздо прочней связаны с ядром соответствующего атома. Поэтому в химических реакциях эти электроны никогда не теряются в пользу другого атома (при образовании ионных связей) и даже не обобществляются с другими атомами (при образовании ковалентных связей). 1s-орбиталь (1s-электроны) не являются валентными, соответственно, подробно анализировать распределение электронов на таких орбиталях не требуется. В дальнейшем схематично будет разбираться заселение электронами только высоколежащих и сопоставимых по энергии валентных орбиталей!
ü По периоду в соответствии с ростом заряда ядра энергия валентных атомных орбиталей постепенно понижается. Это согласуется с качественными рассуждениями о том, что растет притяжение электронов к ядру. Более строго этот вывод можно обосновать с использованием формулы (1.27) на стр.25 (сомножитель Ео < 0, см. формулу (1.15) на стр.15). Сопоставление энергии валентных АО элементов одного периода будет полезным, когда речь пойдет об изменении радиусов, электроотрицательности атомов.
ü Тот факт, что 2s-орбитали понижают свою энергию чуть сильней, чем 2р-орбитали объясняется большей проникающей способностью s-орбиталей, они "лучше чувствуют" растущий заряд ядра. Это несколько увеличивает разницу в энергиях между 2s- и 2р-орбиталями, что постепенно затрудняет возбуждение атомов.[3]
Рассмотрим кратко валентные возможности обсуждаемых атомов. Схема распределения электронов на валентных орбиталях:

Атом бора очень легко переходит в возбужденное состояние и практически во всех своих ковалентных соединениях использует для связывания с атомами-партнерами все три валентных электрона. Более того, за счет имеющейся пустой АО атом В может выступать акцептором электронных пар и поэтому, как мы убедимся в дальнейшем, особенно хорошо связывается с атомами-донорами (например, с атомами N, O, галогенами). Самым простым подтверждением этих слов является высокая стабильность нитрида BN, оксида B2O3 и галогенидов (особенно, фторида BF3) бора, а также легкость образования ионов [В(ОН)4]–, [BF4]–, в которых атом бора четырехвалентен:
BF3 + F–  [BF4]–[4]
[BF4]–[4]
Атом азота, наоборот, с атомами-донорами связывается плохо (кислородные соединения, галогениды азота малоустойчивы). В то же время атом N во многих соединениях также четырехковалентен (самые известные примеры: NH4+, HNO3). Причем в ионе аммония четвертая связь получена по донорно-акцепторному механизму (за счет донорных свойств самого атома азота):
NH3 + H+  [NH4]+,
[NH4]+,
а в молекуле азотной кислоты четвертая связь образована атомом N* за счет 2р-орбитали с электронной парой[5]. Позднее мы выясним, почему донорные способности атома азота достаточно хорошо реализуются при связывании с H+ или атомами Si и хуже – при связывании с другими элементами III-го периода.
Атом неона химически ни с какими другими атомами не связывается. Казалось бы, атом Ne – потенциальный донор электронных пар, но, чтобы эти способности реализовать атому-донору, как правило, требуется иметь отрицательный заряд. А для этого необходимо иметь полярные связи с каким-либо партнером, т.е. чтобы установилась связь по донорно-акцепторному механизму, уже должны быть образованы связи за счет орбиталей с неспаренными электронами. В основном состоянии атома неона их нет. Для возбуждения требуется перевод электронов на орбитали другого (III-го) энергетического уровня. Энергия 3s-орбитали слишком велика (см. рис.1.10) и в химических реакциях такие затраты никогда не окупаются.
Рассмотрим электронное строение элементов III-го периода. Валентным для них является третий энергетический уровень. На третьем энергетическом уровне вначале будет заполняться электронами 3s-орбиталь:
Na  , Mg
, Mg  .
.
Наличие пустых 3р-, а, тем более3d-орбиталей в атоме натрия не имеет никакого существенного значения, поэтому их часто вообще не указывают, также, как и 3d-орбитали атома магния.[6] Роль орбиталей усиливается в химии р-элементов (Al…Cl, Ar).
Электронные формулы некоторых атомов:
Al P Ar



Соотношение в энергиях валентных орбиталей и схемы распределения электронов на них:

Из анализа приведенных схем нетрудно понять, что атом алюминия легче, чем следующие за ним р-элементы переходит в возбужденное состояние. Более того, в своих соединениях с неметаллическими элементами алюминий никогда не остается трехковалентным: будучи потенциальным акцептором электронных пар, Al* обязательно использует в дополнительном связывании остающуюся пустой 3р-орбиталь, а при связывании с сильно электроотрицательными атомами – еще и 3d-орбитали. Например, галогениды AlГ3 состоят вовсе не из четырехатомных молекул. Иодид и бромид алюминия, строго говоря, имеют состав Al2Г6 (каждый атом алюминия связан с четырьмя атомами галогена):
 Хлорид, фторид, а также кислородные соединения (оксид, гидроксид) алюминия являются ионно-ковалентными полимерами, в структуре которых каждый атом Al связан с шестью партнерами. Но наиболее простыми примерами частиц, в составе которых атом алюминия поддерживает связь с шестью другими атомами, являются островные ионы [AlF6]3–, [Al(OH)6]3–, [Al(OH2)6]3+. Как видно, Al3+ является более активным акцептором электронных пар, чем атом бора. Используя свои 3d–орбитали, он способен связываться с большим числом атомов-доноров.
Хлорид, фторид, а также кислородные соединения (оксид, гидроксид) алюминия являются ионно-ковалентными полимерами, в структуре которых каждый атом Al связан с шестью партнерами. Но наиболее простыми примерами частиц, в составе которых атом алюминия поддерживает связь с шестью другими атомами, являются островные ионы [AlF6]3–, [Al(OH)6]3–, [Al(OH2)6]3+. Как видно, Al3+ является более активным акцептором электронных пар, чем атом бора. Используя свои 3d–орбитали, он способен связываться с большим числом атомов-доноров.
Обсудим проблему использования 3d–орбиталей в связывании на примере более знакомых элементов – азота и фосфора.

Сравнив однотипные соединения данных элементов, можно сделать вывод, что 3d–орбитали атома фосфора активно используются в процессах возбуждения и донорно-акцепторном взаимодействии в тех соединениях, где фосфор связан с более электроотрицательными элементами и имеет положительные степени окисления. Это косвенно свидетельствует о том, в этих случаях 3d–орбитали становятся энергетически более доступными, более выгодными, т.е. понижают свою энергию.[7] Для примера кратко сравним структуру и стабильность соединений азота и фосфора в степенях окисления –III и +V:
| –III | +V | |||
| Ковалентные соединения | Ковалентные галогениды | |||
| NH3, NH4+ | PH3, PH4+ | NГ5 | PF5, PCl5, PBr5 [PF6]–, [PCl6]– | |
Устроены одинаково, но из-за большего радиуса атома фосфора PH3, PH4+ гораздо менее стабильны:
 .
Соединение состава РН5 не известно. .
Соединение состава РН5 не известно.
| Не известны | Не смотря на большую длину связи, получены PF5, PCl5, PBr5. Стабильность падает из-за увеличения радиуса галогена, но фторид и хлорид образуются в условиях горения фосфора в атмосфере соответствующего галогена. | ||
| Ионные соединения | Ковалентные кислородные соединения | |||
| Mg3N2 | Mg3P2 | N2O5, HNO3 | (P2O5)n, Р4О10 (НРО3)n, Н3РО4 и другие | |
| Устроены одинаково, фосфиды менее стабильны, чем нитриды. | Различаются и состав, и структура веществ. Например:
 Не смотря на большую длину связи, соединения фосфора (+V) более разнообразны и более стабильны.
Не смотря на большую длину связи, соединения фосфора (+V) более разнообразны и более стабильны.
| |||
У следующих за фосфором элементов (S и Cl) 3d–орбитали также используются в дополнительном взаимодействии (например, в кислородных соединениях). Однако акцепторные способности постепенно уменьшаются из-за растущей электроотрицательности элементов. Замыкающий период аргон, как He и Ne является инертным элементом, в химическом связывании не участвует, т.к. в атоме отсутствуют неспаренные электроны.
Таким образом, электронное строение внешних уровней элементов II-го и III-го периодов в основном состоянии совпадает. Однако при связывании с более электроотрицательными элементами валентные возможности атомов III-го периода увеличиваются благодаря наличию пустых 3d–орбиталей.
Следом за аргоном располагается элемент калий. Поскольку последний 19-тый электрон этого атома располагается на 4s-орбитали, калий возглавляет IV-й период:
К  , Са
, Са 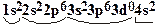 .
.
По той причине, что 3d–орбитали заселяются электронами у элементов IV-го периода, отличает его от двух предыдущих. Четвертый и последующие периоды называют большими. Начинаются и завершаются все большие периоды, как и периоды типических элементов (II-ой и III-й) двумя ns– и шестьюnp–элементами. Но между ними вклиниваются, так называемые, переходные элементы, у которых идет заполнение или (n-1)d– (в IV-м и V-м периодах):

 ,
,
или (n-1)d– и (n-2)f–орбиталей (в VI-м и VII-м периодах; здесь n– главное квантовое число внешних электронов, совпадающее с номером периода). Такая структура больших периодов согласуется с правилами В.Клечковского, с энергиями соответствующих АО. В коротком варианте Периодической системы элементы длинных периодов располагают в двух рядах. В итоге в вертикальных столбцах (группах) оказываются элементы разных типов. Поэтому каждая вертикальная группа элементов в свою очередь подразделяется на две подгруппы. Главныеподгруппы объединяют s–или р–элементы с одинаковым электронным строением внешнего энергетического уровня. Побочныеподгруппы объединяют только d–элементы. Распределение электронов на (n-1)d– и ns–орбиталях этих атомов зачастую различается. Поскольку энергии этих АО довольно близки (см. рис.2.10 на стр.29), порой наблюдаются электронные проскоки с ns– на (n-1)d–орбитали. В коротком варианте таблицы f–элементы вынесены в отдельные строки: лантаноиды (4f–элементы) и актиноиды (5f–элементы).
Рассмотрим электронное строение некоторых элементов d– (Sc, Cr, Fe, Cu) и р–элементов (Ga, As, Kr) IV-го периода.
Sc является первым 3d–элементом:  .
.
Волнистыми линиями выделены сопоставимые по энергии валентные орбитали атома скандия. В атомах титана и ванадия идет последовательное увеличение числа 3d–электронов, а в атоме хрома наблюдается электронный проскок и формируется полузаполненный 3d–подуровень:
Cr  .
.
В атоме марганца 3d5–конфигурация сохраняется, а дополнительный электрон заселяет 4s–орбиталь. В атомах Fe, Co и Ni опять возобновляется заполнение 3d–подуровня, причем полностью завершенным он оказывается в атоме меди (вновь происходит "провал" электрона с 4s–орбитали на 3d–подуровень):
Fe  Cu
Cu  .
.
Соотношение в энергиях валентных орбиталей и схемы распределения электронов на них:

С ростом заряда ядра энергия всех валентных АО уменьшается. Особенно быстро стабилизируются 3d–орбитали, постепенно они становятся самыми "низколежащими". Как отмечалось ранее на примере р-элементов, дополнительно энергия 3d–орбиталей понижается при ионизации атомов. Поэтому в ионах 3d–металлов остающиеся валентные электроны расположены на 3d–орбиталях:
Fe …3d64s24p0 Fe2+ …3d64s04p0 Fe3+ …3d54s04p0

Постепенная стабилизация 3d–орбиталей делает их практически невалентными уже для Zn и, тем более, для последующих 4р-элементов. Более того, в положительных степенях окисления 3d–орбитали дополнительно отдаляются по энергии от 4s– и 4р-орбиталей, а вот "высоколежащие" 4d–орбитали, наоборот, приближаются к валентным АО и могут быть использованы для возбуждения атома, и в донорно-акцепторном взаимодействии:
Ga:  , As:
, As:  , Kr:
, Kr: 

Как видно, строение внешнего уровня этих атомов очень сходно с таковым для Al, P и Ar, а атомы второго периода (B, N и Ne) имеют такое же число валентных электронов, характеризуются таким же их распределением (ns2np1, ns2np3, ns2np6, соответственно), но не имеют пустых nd–орбиталей. Как следствие, структура и свойства однотипных соединений элементов III-го и IV-го периодов гораздо более сходны между собой и, в свою очередь, существенно отличаются от аналогичных соединений элементов II-го периода.[8]
С учетом всего вышесказанного можно сформулировать периодический закон(впервые в несколько ином виде предложенный Д.И.Менделеевым, 1869г.): свойства атомов, состав, структура и свойства образуемых ими однотипных соединений находятся в периодической зависимости от зарядов их ядер. То есть, при постепенном, монотонном изменении заряда ядра (порядкового номера элемента) периодически повторяется (у элементов одной подгруппы) электронная структура внешнего энергетического уровня, ответственного за валентные возможности атомов. Поэтому наблюдается периодическое повторение состава, структуры и свойств веществ. Но, как уже было показано на примере B–Al–Ga и, более подробно, на примере N–P–As структура и свойства атомов (веществ) не повторяются абсолютно. Наблюдается и закономерное их изменение. Оно обусловлено как изменением радиусов атомов, так и наличием (отсутствием) валентных nd-орбиталей. Различия в свойствах атомов (веществ) могут быть вызваны и различиями в структуре предвнешнего энергетического уровня.8
Дата добавления: 2014-11-13; просмотров: 566; Мы поможем в написании вашей работы!; Нарушение авторских прав |