
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Межмолекулярное взаимодействие.
В настоящее время под термином межмолекулярное взаимодействие понимают любые процессы ведущие к образованию как агрегатов, состоящих из нескольких молекул исходных веществ, так и агрегатов, образованных огромным числом молекул (порядка числа Авогадро). Первый тип взаимодействия приводит к образованию n-меров (ди-, три- и т.д.), другой определяет состояние и вероятность системы, состоящей только из молекул данного вещества. Механизмы межмолекулярных взаимодействий отличны между собой, но результат этих взаимодействий один – понижение внутренней энергии системы и уменьшение ее энтропии, т.е. любое межмолекулярное взаимодействие при изобарном процессе предопределяется энтальпийным фактором.
В середине XIX века было показано, что любая реальная газовая система, отличается от модели идеального газа, в которой постулируется отсутствие взаимодействий между молекулами. В то же время было установлено, что реальные и идеальные системы могут быть согласованы, если предположить, что молекулы, образующие данную систему, взаимодействуют друг с другом и энергия этого взаимодействия строго индивидуальна для этого вещества и значительно меньше энергии связей атомов в молекулах. Для согласования уравнений состояния идеальных и реальных газов Ван-дер-Ваальс вводит поправочное слагаемое в соответствующие уравнения, учитывающие межмолекулярные взаимодействия и показывает, что последние играют существенную роль в процессах расширения газов, конденсации, адсорбции, растворении и т.д.. Этот тип межмолекулярного взаимодействия получил название сил Ван-дер-Ваальса. В настоящее время показано, что они действуют в молекулярных веществах, находящихся в газообразном, жидком и твердом состояниях.
Природа данных сил была выяснена в начале ХХ века, после того как был решен вопрос о строении атомов и молекул. Оказалось, что данные силы имеют электростатическую природу и являются результатом действия трех эффектов – ориентационного, индукционного и дисперсионного.
2.5.1. Ориентационный эффект.
Он возникает только между полярными молекулами, которые обладают собственным дипольным моментом. При этом молекулы вещества ориентируются друг по отношению к другу разноименными полюсами, и в результате такого дипольного взаимодействия возникает хотя и лабильная, но все же относительно упорядоченная структура. В 1912 году Крезом было показано, что энергия ориентационного взаимодействия может быть выражена следующим соотношением:
Еор = – 

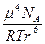 = –
= – 
где m – собственный дипольный момент молекулы, r – расстояние между центрами диполей, NА – число Авогадро, R – универсальная газовая постоянная, Т – абсолютная температура. Таким образом, ЕОР тем больше, чем больше значение m и чем меньше величина r. При этом, с ростом Т ЕОР уменьшается, так как усиливающееся тепловое движение нарушает взаимную ориентацию диполей. Вклад Еор в суммарное межмолекулярное взаимодействие велик для молекул, обладающих большим дипольным моментом (H2O, NH3 и т.д.)
Дата добавления: 2014-11-13; просмотров: 327; Мы поможем в написании вашей работы!; Нарушение авторских прав |