
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Эл. конф. иона 18е 18е 18е
Близость Кд гидроксидов элементов одной и той же подгруппы связана с компенсацией фактора, уменьшающего поляризующее действие ионов (рост радиусов), фактором, увеличивающим их поляризующее действие (изменение электронной конфигурации от 8е к 18е).
Значительное влияние на степень диссоциации гидроксидов оказывает и их химическое строение, например:
(HPO3)3 H4P2O7 H3PO4
H3P3O9
K1 1,14 3,0·10–2 7,6·10–3
К2 2·10–1 4,4·10–3 6,210–8
К3 9·10–3 2,5·10–7 4,410–13
В молекулах всех трех представленных кислот степень окисления фосфора +5, т.е. его поляризующее действие формально одинаково, что может без учета фактора строения этих веществ привести к неверному выводу о близких значениях Кд всех форм фосфорных кислот. На рис.10.2 представлены графические формулы молекул рассматриваемых соединений.

Рис.10.2.. Графические формулы фосфорных кислот
 Из рис.2.5 видно, что причиной изменения Кд этих кислот является различная односторонняя деформация ионов О2– окружающих ион Р5+. Наибольшую одностороннюю деформацию испытывают ионы кислорода в группировке, так как они непосредственно связаны только с одним атомом фосфора, что уменьшает положительный заряд последнего на величину D, т.е. снижает значение его ПД.
Из рис.2.5 видно, что причиной изменения Кд этих кислот является различная односторонняя деформация ионов О2– окружающих ион Р5+. Наибольшую одностороннюю деформацию испытывают ионы кислорода в группировке, так как они непосредственно связаны только с одним атомом фосфора, что уменьшает положительный заряд последнего на величину D, т.е. снижает значение его ПД.
 |
При присоединении к одному из атомов кислорода иона Н+ за счёт контрполяризующего действия указанной частицы отрицательный заряд на двух других атомах кислорода уменьшается, что снижает способность частицы к присоединению следующих ионов водорода, т.е. степень гидролиза последующих форм (кислых ионов) снижается, а степень диссоциазии их возрастает. За счёт высокой основности полярность связи Н–О в молекуле Н3РО4 невелика, что предопределяет относительно низкие значения ее Кд. Если же группировки соединяются друг с другом через атом кислорода, то поляризующее действие иона фосфора изменяется мало:

(односторонней деформации электронной плотности иона кислорода в сторону одного из атомов фосфора препятствует равное по величине и противоположное по направлению ПД другого иона фосфора).
Таким образом, при формировании цикла поляризующее действие ионов фосфора, входящих в его состав, оказывается значительно выше, чем у иона фосфора, входящего в состав фосфат-иона, что и предопределяет более высокую степень диссоциации триметафосфорной кислоты по сравнению с H3PO4. Рассуждая аналогичным образом, можно прийти к выводу, что по степени диссоциации H4P2O7 будет занимать промежуточное положение между H3P3O9 и H3PO4. Из выше сказанного следует важный вывод: с ростом числа групп ОН–, непосредственно соединенных с одним и тем же центральным ионом сила кислот будет уменьшаться.
Последовательная ионизация многоосновных кислот и многокислотных оснований также приводит к изменению ПД центральной частицы. При отщеплении иона водорода от группа –ОН, отрицательный заряд на ионе кислорода возрастает, что увеличивает его деформируемость. Это, в свою очередь, приводит к снижению ПД центральной частицы и уменьшению деформации ионов кислорода в оставшихся в анионе групп –ОН. Как было показано выше, это уменьшает значения Кд по кислотному типу:
H3PO4  H+ + H2PO4– K1=7,6 · 10-3
H+ + H2PO4– K1=7,6 · 10-3
H2PO4–  H+ + HPO42– K2=6,2 · 10-8
H+ + HPO42– K2=6,2 · 10-8
HPO42–  H+ + PO43– K3=4,4 · 10-13
H+ + PO43– K3=4,4 · 10-13
При диссоциации по основному типу отщепление группы ОН– от гидроксида увеличивает ПД катиона и полярность связи между катионом и анионами кислорода оставшихся групп ОН уменьшается, что затрудняет процесс диссоциации по данному типу. Например, для «Pb(OH)2» константы диссоциации по основному типу составляют: К1=9,5·10–4, К2=3,0·10–8.
Как уже отмечалось ранее, поляризующее действие ионов и их взаимная деформируемость предопределяет не только преимущественный характер диссоциации соединений типа R–О–Н и глубину протекания процесса их ионизации, но и состав этих соединений. Рассмотрим данный вопрос на примере гидроксидов элементов III периода Периодической системы. Например, теоретически гидроксид Р(V) может иметь состав Р(ОН)5. Однако за счет высокого поляризующего действия ионов Р5+ происходит значительная односторонняя деформация электронной плотности анионов кислорода групп ОН, что должно способствовать уменьшению длин связей Р–О–. Но сближение групп ОН с центральной частицей приводит к увеличению отталкивания между ними. Противодействие сил отталкивания и притяжения способствует тому, что часть связей Р–О действительно укорачивается, тогда как другие удлиняются:

Уменьшение длины и полярности связи между ионом фосфора и кислорода, как было показано выше, облегчает отрыв иона Н+, тогда как с ростом длины связи Р–О возрастает вероятность диссоциации соединения по основному типу. В результате этого в системе протекает процесс "внутримолекулярной нейтрализации", сопровождающийся образованием молекулы Н2О. Атом кислорода, оставшийся у иона фосфора после отщепления молекулы Н2О, за счет наличия на нем отрицательного заряда еще сильнее деформируется центральным ионом. Это способствует образованию между этими частицами дополнительной связи и снижению ПД иона фосфора. В связи с уменьшением ПД центральной частицы деформация оставшихся 3-х групп ОН уменьшается, что снижает вероятность дальнейшего протекания процесса, связанного с уменьшением основности кислоты. В тоже время, при бóльшем ПД центральной частицы становятся возможными и последующие его стадии:

Таким образом, можно сделать вывод, что с ростом ПД центрального иона основность кислот будет уменьшаться. (В приведенном примере ионы Р5+, S6+, Cl7+ имеют одинаковое строение электронных оболочек, а их радиусы по Полингу равны r(Р5+)=0,34Å, r(S6+)=0,29Å, r(Cl7+)=0,26Å, что с учетом роста зарядов ионов резко увеличивает ПД по ряду слева направо.)
Ион Si4+ по сравнению с Р5+ характеризуется меньшим ПД, поэтому одной из форм кремниевых кислот является H4SiO4 – ортокремниевая кислота. Снижение ПД центрального иона приводит к сближению значений Кд этого гидроксида по кислотному и основному типу. За счет этого между молекулами данного гидроксида протекает процесс поликонденсации ("межмолекулярной нейтрализации"):
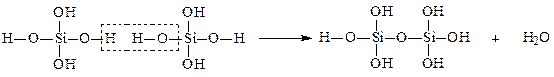
Так как появление атома кислорода между двумя атомами кремния мало влияет на значения ПД центральных частиц, дальнейший процесс поликонденсации приводит к образованию многочисленных полимерных форм кремниевых кислот линейного, слоистого или объемного строения. С ростом степени поликонденсации растворимость образующихся соединений уменьшается, и они выделяются из раствора в виде геля или же образуют с с жидкой фазой коллоидный раствор.
При уменьшении заряда катиона на единицу при сохранении электронной конфигурации иона (Al3+) Кд по кислотному и основному типу остаются достаточно близкими ( в отличие от H4SiO4 Кд гидроксида Al(III) по основному типу больше, чем Кд по кислотному). Это, как мы видели на примере H4SiO4, должно приводить к формированию полимерной структуры этого вещества и выделению его из раствора в виде гелеобразной фазы. Такая же ситуация сохраняется и в случае Кд осн>>Кд кис, однако степень поликонденсации в этом случае значительно ниже, чем в случае гидроксида Al(III). Это, в частности приводит к тому, что растворимость гидроксида Mg(II) в воде в среднем в 1000 раз выше, чем у гидроксида Al(III). При дальнейшем снижении ПД катиона процесс поликонденсации подавляется, поэтому крупных полимерных частиц в растворах NaOH или Ca(OH)2 не фиксируется. Отсюда следует важный в практическом отношении вывод:
1. Одноядерные формы гидроксидов кислотного типа образуются только в случае достаточно высокого ПД центральной частицы аниона. Эти формы хорошо растворимы в Н2О и имеют высокие значения степени электролитической диссоциации.
2. При среднем ПД катиона образуются полимерные формы гидроксидов, плохо растворимые в воде и имеющие низкие значения Кд как по основному, так и по кислотному типу.
3. Гидроксиды катионов, характеризующихся низким ПД, представляют собой кристаллические вещества с преимущественно ионным характером связи. Они хорошо растворимы в воде и их степень диссоциации по основному типу равна 100% (по первой стадии в случае двухкислотных гидроксилов).
В заключение отметим положительные и отрицательные стороны теории поляризации. Ценность любой теории оценивается с точки зрения степени согласования ее выводов с экспериментальными данными. Как следует из выше изложенного, теория поляризации дает правильный прогноз химических и физико-химических свойств разнообразных веществ, предсказывает их строение и состав. Однако выводы этой теории скорее качественные, чем количественные. Например, с ее помощью можно показать, что ВеО·хН2О будет амфотерным и его Кд по основному и кислотному типу имеют низкие значения, но она не позволяет рассчитать абсолютные величины этих констант. С другой стороны успешно интерпретируя изменение свойств соединений с одинаковой электронной структурой (по периодам и подгруппам), теория поляризации сталкивается со значительными трудностями при сравнении строения и свойств соединений, в состав которых входят ионы различных подгрупп с одинаковым строением электронных оболочек. Например, ионы Cr6+ и S6+ имеют 8е оболочку, r(Cr6+)=0,52Å, r(S6+)=0,29Å, следовательно ПД S6+ выше ПД Cr6+, что подтверждается значениями К2 для H2SO4 и H2CrО4, которые равны, соответственно, 1,2·10–2 и 3,2·10–7, и более низкой термической H2CrО4 устойчивостью по сравнению с H2SO4. Но тогда с точки зрения теории поляризации основность хромовой кислоты должна быть выше, чем серной, что не подтверждается на опыте. Hапример, дихромовая кислота могла бы иметь строение:

тогда как экспериментально установлено, что она двухосновна:
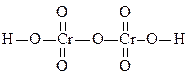
Рассчитать, какая же из представленных форм для дихромовой кислоты энергетически более выгодна, теория поляризации не позволяет. Однако, несмотря на указанные недостатки, рассмотренная теоретическая концепция дает возможность ориентироваться в разнообразном фактическом материале неорганической химии без использования сложных математических расчетов, что выгодно отличает ее от квантовомеханических теорий химической связи.
Дата добавления: 2014-11-13; просмотров: 435; Мы поможем в написании вашей работы!; Нарушение авторских прав |