
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теория Льюиса и метод ОЛЭП.
Теория предложенная Косселем удовлетворительно описывает химическую связь только в фазах образованных атомами элементов значительно отличающихся по своей электроотрицательности, т.е. ограниченное число химических объектов. Другой подход к проблеме интерпретации понятия «химическая связь» развивался параллельно с формированием представлений о ионной связи. В 1907 Н.А. Морозов и в 1916-1918 годах Д.Н.Льюис выдвинули гипотезу, согласно которой образование химической связи обусловлено образованием в процессе взаимодействия атомов общей электронной пары, локализующейся в межядерном пространстве. На образование указанной пары каждый из соединяющихся атомов поставляет по одному электрону валентного уровня, электронная пара взаимодействует с ядрами обоих этих атомов в результате чего в системе возникают как силы притяжения так и отталкивания (рис.1.7). Наличие двух типов взаимодействий в системе должно в конечном итоге приводить к достижению системой состояния равновесия, характеризующегося локальным минимумом энергии.
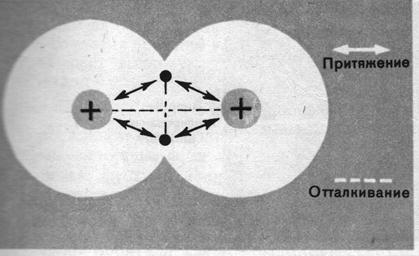
Рис.1.3. Схема сил электростатического притяжения и отталкивания в молекуле Н2.
При этом стабильность рассматриваемой системы будет предопределяться соотношением сил отталкивания и притяжения, так же как в случае формирования ионной связи (рис.1.3). Каждую общую электронную пару Льюис предложил обозначать точками или одной чертой c указанием числа неподелённых электронных пар. Это было необходимо для продтверждения основной гипотезы описанных выше представлений о стремлении каждого из атомов к достройке внешней оболочки до 8 или 2-х электронной: 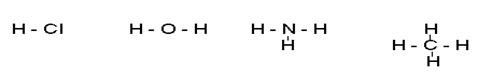
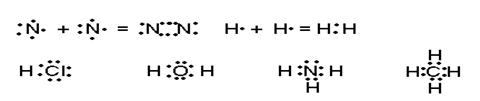
Рис.2.3. Изображение ковалентной связи в молекулах по Льюису.
Связь, в основе образования которой лежит обобществление валентных электронов, Льюис назвал ковалентной. Пары обеспечивающие химическую связь называются связующими, а локализованные у исходных атомов – неподелёнными, например в молекуле Н2О (рис.2.3) у атома кислорода две связующие электронные пары и две неподелённые. Принимая во внимание, что ковалентная связь может возникать как между атомами одного элемента, так и между атомами с различной электроотрицательностью, было высказано предположение, что в первом случае общая электронная пара будет располагаться в центре тяжести ядер соединяющихся атомов, а во-втором –смещаться в сторону более электроотрицательного атома. Связь первого типа была названа неполярной, например. молекулы H2. N2, а второго типа – полярной ковалентной (молекулы HCI, H2O, NH3, CH4 - рис.2.3).
Несмотря на то, что в основе теорий и Косселя и Льюиса лежат электростатические представления, характер постулируемой в них локализации электронной плотности различен, что приводит к выводам о различных свойствах формирующихся в системах связей. Ионы имеют сферическую симметрию окружающего их электрического поля, способного воздействовать на заряженные частицы в любом направлении. Поэтому их координационные числа зависят, преимущественно, от относительных размеров образующих фазу ионов и, следовательно, могут варьироваться в некоторых пределах (например, к.ч. иона хлора в хлориде натрия и цезия - см. модуль 2). Указанные факторы предопределяют ненаправленность и ненасыщаемость ионной связи. Ковалентные же связи локализованы между отдельными, соединёнными между собой атомами и имеют строгую направленность в пространстве, т.е в отличии от ионных они насыщаемы, а углы между ними (валентные углы по Льюису) имеют строго определённые значения при фиксированных параметрах системы.
Необходимо отметить, что уже на первом этапе развития представлений о ковалентной связи её авторы столкнулись со значительными трудностями в вопросе предсказания состава молекул различных элементов. Как отмечалось выше, в теории Льюиса внимание концентрируется на окружении каждого атома октетом электронов (или наличием у атома водорода электронной пары). Однако имеется большое количество молекул, радикалов и молекулярных ионов, для которых это правило не выполняется и существование которых данной теорией не прогнозируется. Такие частицы могут быть условно разделены на три типа.
К первой группе относятся молекулы с нечётной суммой электронов в системе, например, NO, NO2, CIO2 и т.д.. В молекулах данного типа число электронов, окружающих атомы азота и хлора нечётное и по определению не может равняться восьми.
Второй возможный случай нарушения правила октета характерен для молекул, в состав которых входят элементы главных и побочных подгрупп I, II и III групп. Например, в галогенидах бора общее число электронных пар окружающих атом бора равно трём, а в галогенидах бериллия и лития (образующих газообразную фазу этих веществ) число таких пар – две и одна, соответственно.
К третьему типу веществ, не подчиняющихся правилу октета, относятся большинство молекулы, в состав которых входят элементы V, VI, VII и VIII групп. Например, в молекулах галогенидов фосфора состава РГ5 и в Р2О5 число связующих электронных пар, окружающих атом фосфора, равно пяти, в оксидах серы SO2 и SO3 – общее число пар вокруг атомов серы 5 и 6, соответственно, в SF6 – 6, а в CI2O7 окружение атома хлора – 7 связующих электронных пар, в RеO4 и XеO4 - 8 и т.д..
Приведённые примеры показывают, что классическая теория Льюиса, хотя и является существенным шагом вперёд по сравнению концепцией ионной связи, обладает низкой предсказательной способностью в вопросах о составе молекул элементов, большинства подгрупп Периодической системы.
Больших успехов представления о локализованной между ядрами электронной плотности достигли в интерпретации строения молекул. Простой метод определения геометрической формы молекулы был предложен Гиллеспи. В основе этого метода лежит модель отталкивания локализованных электронных пар (МОЛЭП). Модель предполагает, что связующие и неподелённые электронные пары, окружающие центральный атом, для минимизации энергии отталкивания удаляются друг от друга на максимально возможное расстояния, что предопределяет оптимальное (с точки зрения энергии систем) значения углов связей (при фиксированном числе указанных пар).

Рис.3.3. Расположение связующих электронных пар в пространстве вокруг центрального атома А при условии отсутствия у этого атома неподелённых электронных пар валентного уровня. Число связующих пар: а) две, б) три, в) четыре, г) пять, д) шесть, е) семь.
В первом приближении энергию отталкивания всех связующих пар можно считать одинаковой, тогда их расположение в пространстве будет симметричным ( рис.3.3).
Иную конфигурацию будут иметь молекулы, у которых центральный атом имеет неподелённые электронные пары (рис.4.3) и электрические поля которых также необходимо учитывать при расчёте минимума энергии системы. Из рис.4.3 следует, что при наличии у атома А неподелённой электронной пары, последняя занимает одну из вершин исходного полиэдра. Так как электрическое поле этой пары не скомпенсировано вторым ядром, его напряжённость выше по сравнению с напряжённостью электрического поля связующей парой выше, что приводит к сближению связующих пар в пространстве, т.е к уменьшению угла связи (рис.5.3).

Рис.4.3. Распределение в пространстве связующих и неподелённых электронных пар вокруг центрального атома А. Число неподелённых электронных пар центрального атома указано при символе Е, обозначающего одну такую пару.
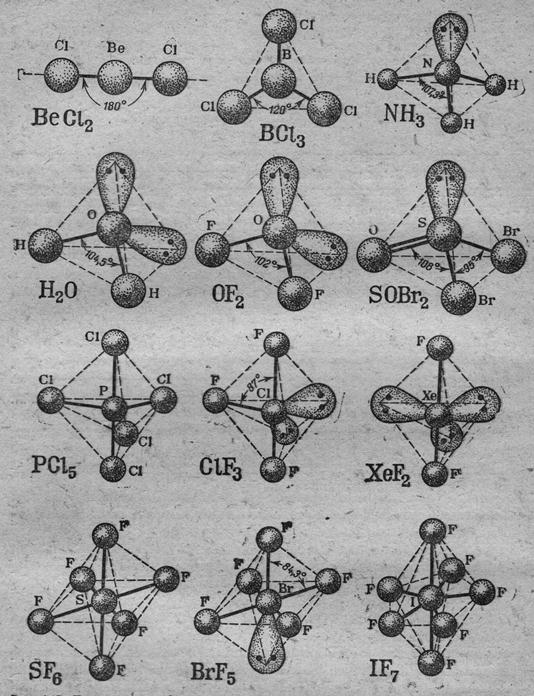
Рис.5.3. Форма молекул и углы между связями для различного числа связующих и неподелённых электронных пар у центрального атома. Неподелённые электронные пары изображены в виде вытянутой фигуры, дающей представление об области их локализации в пространстве вокруг центрального атома. Сплошными линиями обозначены связывающие эектронные пары.
Результаты расчёта по МОЛЭП могут быть уточнены с помощью трёх дополнений:
1. Напряжённость электрического поля в области двойной связи больше, чем в области одинарной.
2. Чем выше электоотрицательность периферийных атомов, входящих в состав молекулы, тем больше локализация неподелённых электронных пар в области центрального атома и тем больше их влияние на валентные углы в молекуле. Например, в однотипных молекулах H2O и OF2 (рис.5.7) валентные углы равны 104,5о и 102о, соответственно.
3. С ростом числа неподелённых электронных пар центрального атома их роль в системе возрастает (рис.6.3).
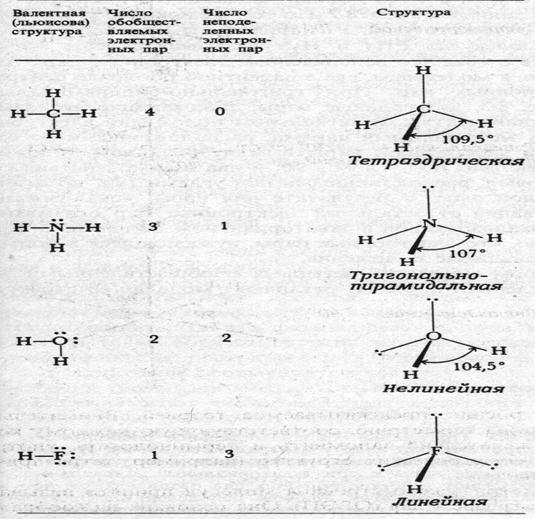
Рис.6.3. Структуры молекул с общим числом электронных пар у партнёров атома водорода равным четырём.
Дата добавления: 2014-11-13; просмотров: 519; Мы поможем в написании вашей работы!; Нарушение авторских прав |