
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Составление уравнений окислительно-восстановительных реакций электронно-ионным методом, или методом полуреакций
Для составления ОВ-реакций используются два метода: метод электронного баланса и электронно-ионный метод. Метод электронного баланса рекомендуется для уравнивания ОВ-реакций, протекающих в газовой или твердой фазах. Для составления ОВ-реакций, протекающих в водных растворах, применяется электронно-ионный метод. В данном учебном пособии он и рассматривается.
При электронно-ионном методе составляют две полуреакции. Одна из них - это окисление восстановителя, другая — восстановление окислителя. Эти две полуреакции суммируют в общее уравнение. В этом методе степени окисления элементов в составе соединений не определяют. Электронно-ионный метод характеризует процессы, которые происходят в условиях протекания реакции. В растворе нет ионов S+4, S6+, Mn7+, но есть ионы SO2-3, SO2-4, МnО-4 . Слабые электролиты, газы и практически нерастворимые вещества записывают в молекулярном виде.
При составлении ионного уравнения для каждой полуреакции надо учитывать количество атомов кислорода и водорода в исходных веществах и продуктах реакции. Баланс атомов О и Н в ОВ-реакциях, протекающих в различных средах, показан в табл. 3.2.
При протекании реакции в кислой среде в полуреакции могут быть только молекулы воды и Н+ - ионы; в щелочной среде — только молекулы воды и ОН- - ионы; в нейтральной — только молекулы воды.
Таблица 3.2. Баланс атомов кислорода и водорода в окислительно-восстановительных реакциях
| Левая часть полуреакции | Среда | В левую часть добавить на 1 атом 0 | В правую часть добавить |
| Недостаток O Избыток O | pH ≤ 7 рН > 7 рН < 7 рН ≥ 7 | Н2О 2ОН- 2Н+ Н2О | 2Н+ Н2O Н2O 2ОН- |
Рассмотрим несколько примеров составления уравнений ОВ-реакций с помощью электронно-ионного метода.
Пример 1 (кислая среда):
Na2SO3 + КМnО4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O.
В ионной форме:
2Na+ + SO2-3 +К+ + MnO-4 + 2H+ + SO2-4 → 2Na+ + SO2-4+ 2К++ SO2-4 +H2O.
Из схемы реакции видно, что в окислении-восстановлении участвуют ионы:
SO2-3 + МnО-4 + 2Н+ → SO2-4 + Mn2+ + Н2О;
SO2-3 → SO2-4 - процесс окисления;
MnO-4 → Mn2+ - процесс восстановления.
Составим ионные уравнения для каждой полуреакции, учитывая число атомов кислорода и водорода (см. табл. 3.2). Число атомов элементов в левой и правой частях уравнения должно быть одинаково:
SO2-3 + Н2O → SO2-4 + 2H+;
МnО-4 + 8Н+ → Мn2+ + 4Н2О.
Составим электронные уравнения для каждой полуреакции, учитывая, что суммарный заряд в левой части уравнения должен быть равен суммарному заряду в правой части уравнения:
SO2-3 + Н2О - 2 ē = SO2-4 + 2H+;
МnО-4 + 8Н+ + 5 ē = Мn2+ + 4Н2О.
Общее число электронов, отдаваемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем. Находим наименьшее общее кратное, на которое делятся 2 и 5. Оно равно 10. Находим коэффициенты для восстановителя и окислителя:
SO2-3 + Н2О - 2 ē = SO2-4 + 2Н+ 5
МnО-4 + 8Н+ + 5 ē = Мn2+ + 4Н2О 2
Суммируем электронно-ионные уравнения, предварительно умноженные на коэффициенты:
5 SO2-3 + 5Н2О + 2MnO-4 + 16H+ = 5 SO2-4 + 10Н+ + 2Мn2+ + 8Н2О.
Сократив подобные члены, получим ионное уравнение
5 SO2-3 + 2МnО-4 + 6Н+ = 5 SO2-4 + 2 Мn2+ + ЗН2О,
по которому составляют молекулярное уравнение реакции. Для этого к каждому аниону приписывают соответствующий катион, а к каждому катиону - соответствующий анион:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
Пример 2 (щелочная среда):
Na2SO3 + KMnO4 + КОН → Na2SO4 + K2MnO4 + Н2О;
2Na+ + SO2-3 + К+ + МnО-4 + К+ + ОН- → 2Na+ + →+
+ 2К+ + MnO2-4 + Н2О
или SO2-3 + MnO-4 + ОН- → SO2-4 + MnO2-4+ Н2О;
SO2-3 → SO2-4 - процесс окисления;
MnO-4 → MnO2-4 - процесс восстановления.
Полуреакции:
SO2-3 + 2ОН- - 2ē = SO2-4 + Н2О 1
MnO-4 + ē = MnO2-4 2
SO2-3 + 2 OH- + 2 MnO-4 = SO2-4 + Н2О + 2 MnO-4.
Молекулярное уравнение реакции:
Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + H2O.
Пример З (нейтральная среда):
Na2SO3 + KMnO4 → Na2SO4 + MnO2↓ + ... .
SO2-3 → SO2-4 - процесс окисления;
MnO-4 → MnO2 - процесс восстановления.
Полуреакции:
SO2-3 + Н2О - 2 ē = SO2-4 + 2Н+ 3
MnO-4 + 2Н2О + 3 ē = MnO2 + 4ОН- 2
3 SO2-3 MnO-4 + 7 Н2О = 3 SO2-4 + 2 MnO2 + 6H+ + 8 OH-.
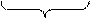
6 H2O + 2 OH-
Сокращенное ионное уравнение:
3 SO2-3 + 2MnO-4 + H2O = 3 SO2-4 + 2MnO2↓ + 2OH-.
Молекулярное уравнение реакции:
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2↓ + 2KOH.
Дата добавления: 2014-11-13; просмотров: 425; Мы поможем в написании вашей работы!; Нарушение авторских прав |