
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Природа химической связи в комплексных ионах
В настоящее время для объяснения образования, строения и свойств комплексных соединений применяются различные теории, но наиболее наглядным и доступным является метод валентных связей (МВС). Согласно МВС, в процессе образования комплексного иона устанавливается прочная связь между комплексообразователем и лигандами. Атом лиганда отдает пару электронов на свободную орбиталь комплексообразователя. Он является донором, атом или ион комплексообразователя - акцептором. Поэтому атомы лиганда присоединяются к комплексообразователю ковалентной полярной связью по донорно-акцепторному механизму. Часто связь по донорно-акцепторному механизму называют донорно-акцепторной или координационной. Донорно-акцепторный механизм образования ковалентной связи схематически изображается в форме стрелки (→), направленной от атома донора к атому акцептора.
Рассмотрим механизм образования комплексного иона [Zn(NH3)4]2+. Для этого изобразим электронные конфигурации молекулы аммиака, атома и иона цинка:

Атом азота в молекуле аммиака имеет неподеленную пару электронов, а ион цинка Zn2+ имеет четыре свободные орбитали. Поэтому при образовании комплексного иона [Zn(NH3)4]2+ роль донора играют четыре молекулы аммиака, а роль акцептора — ион цинка Zn2+, который принимает четыре пары электронов от четырех молекул аммиака. В образовании связи участвуют одна 4s-орбиталь и три 4р-орбитали иона цинка. Комплексный ион [Zn(NH3)4]2+ имеет геометрическую конфигурацию (тетраэдр), что означает осуществление sр3-гибридизации. Образование комплексного иона [Zn(NH3)4]2+ может быть показано и следующим образом:
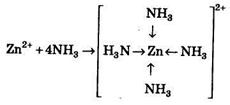
Таким образом, с помощью МВС можно объяснить определенные значения координационных чисел комплексных ионов. С позиций этого метода хорошо объясняются и магнитные свойства комплексных соединений, но с его помощью нельзя объяснить их оптические свойства: цвет и спектры поглощения. Для объяснения других физических и химических свойств комплексных соединений применяется теория кристаллического поля и метод молекулярных орбиталей.
Дата добавления: 2014-11-13; просмотров: 434; Мы поможем в написании вашей работы!; Нарушение авторских прав |