
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородная связь и ее влияние на физические свойства вещества.
Водородн связью назыв доп связь, осуществляемая атомами водорода, ковалентно соединенными в мол с атомами ЭО-ного эл-та. Такой водородн атом оказ-ся протонированным тем сильнее, чем больше ЭОсвязанного с ним атома. Большая плотность положит заряда (вследствие малого радиуса) и отсутствие ẽ-ов у протонироваиного атома водорода способствуют взаимод-ю его с ЭО-ным атомом чужой (или даже своей) мол. Взаимод-е выраж-ся в притяж-и ковалетно связанного «протона» ẽ-ами атома неМе:
 Атом Н оказ-ся связанным сразу с двумя неМе атомами О···Н—О. Водор связь отлич-ся от ков меньшей прочностью. Но она оказ сильн влияние на св-ва соответствующих соед-ний. Напр, образ-ем водор связей
Атом Н оказ-ся связанным сразу с двумя неМе атомами О···Н—О. Водор связь отлич-ся от ков меньшей прочностью. Но она оказ сильн влияние на св-ва соответствующих соед-ний. Напр, образ-ем водор связей
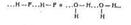 обусловлена резко выраженная склонность к ассоциации молекул фтороводорода и воды. Поэтому вода и фтороводород имеют высокую tкип и в обычн усл-ях сущ-ют в жид сост-нии.
обусловлена резко выраженная склонность к ассоциации молекул фтороводорода и воды. Поэтому вода и фтороводород имеют высокую tкип и в обычн усл-ях сущ-ют в жид сост-нии.
Прочность водор связи уменьш-ся с повышением t°, поэтому водяной пар сост из мол Н2О.
Вследствие большой полярности связи Н—F ассоциация фтороводорода сохран-ся и в парообр сост-и, для к-рого хар-ны полимеры состава (HF)4.
Водор св насыщаема и пространственно направлена. Энергия водор св: Ехим(ион,мет,ков)св≥Евод св>Еван-дер-ваальс.
Дата добавления: 2015-04-18; просмотров: 276; Мы поможем в написании вашей работы!; Нарушение авторских прав |