
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение состояния неидеального газа Ван дер Вальса.
Изменение агрегатного состояния.Критическая точка
Уравнение:
Для 1 моля:

Для нескольких:
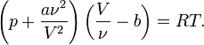
Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
18. Первое начало термодинамики:
при изобарном процессе

при изохорном процессе (A = 0)
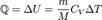
при изотермическом процессе (ΔU = 0)

Здесь 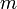 масса газа,
масса газа,  — молярная масса газа,
— молярная масса газа,  — молярная теплоемкость при постоянном объёме, причём последнее равенство верно только для идеального газа.
— молярная теплоемкость при постоянном объёме, причём последнее равенство верно только для идеального газа.
Внутренняя энергия идеального газа(не зависит от объема и давления)
 .
.
ΔU = νCVΔT,
где ν — количество вещества, ΔT — изменение температуры.
Вн энергия неидеального газа :
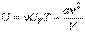
Удельная теплоемкость вещества:
c = Q / (mΔT).
Молярная :
C=M*c.
CV– молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе(p = const).
QV = CV ΔT = ΔU.
Qp = ΔU + p (V2 – V1) = CV ΔT + pΔV,

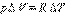
Т е:
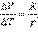
А тогда:
Cp = CV + R.
 (входит в уравнение адиабатического процесса)
(входит в уравнение адиабатического процесса)
Итак:
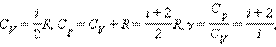
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы. Так как передачи теплоты при адиабатическом процессе не происходит, то 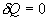 и уравнение I начала термодинамики принимает вид
и уравнение I начала термодинамики принимает вид
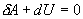 .
.
Дата добавления: 2015-04-21; просмотров: 240; Мы поможем в написании вашей работы!; Нарушение авторских прав |