
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 2. Стандартное химическое сродство металлов к кислороду, сере, галогенам. Взаимосвязь сродства и окислительно-восстановительных процессов.
Чтобы можно было сравнивать между собой поведение веществ в однотипных реакциях или одних и тех же веществ в разных реакциях следует отсчитывать их способность к химическому реагированию, во всех случаях необходимо принимать исходное состояние системы одинаковым.
Лучше всего, если это будет стандартное состояние, В этом случае конденсированные вещества должны быть чистыми, а газы – иметь парциальное давление равное 1 атмосфере.
Уравнение Вант-Гоффа превращается в уравнение 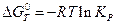 . Для различных веществ строятся графики зависимости
. Для различных веществ строятся графики зависимости  , и по ним можно дать любые сравнительные оценки относительно поведения веществ при процессах.
, и по ним можно дать любые сравнительные оценки относительно поведения веществ при процессах.

 температуры начала восстановления, соответственно Cu,Fe,Ca.
температуры начала восстановления, соответственно Cu,Fe,Ca.
Из данного графика видно, что:
-почти все металлы в области низких, умеренных и высоких температур способны реагировать с кислородом и образовывать устойчивые оксиды;
-чем более отрицательна величина  реакции образования оксида, тем выше сродство металла к кислороду и более устойчивыми образуются оксиды. (Оксид кальция наиболее прочный, наименее прочный – оксид ртути);
реакции образования оксида, тем выше сродство металла к кислороду и более устойчивыми образуются оксиды. (Оксид кальция наиболее прочный, наименее прочный – оксид ртути);
-с повышением температуры величина  реакции образования оксидов становится более положительной. Сродство металлов к кислороду уменьшается, уменьшается также термодинамическая прочность оксидов;
реакции образования оксидов становится более положительной. Сродство металлов к кислороду уменьшается, уменьшается также термодинамическая прочность оксидов;
-металлы и вещества, у которых более высокое сродство к кислороду, используют в качестве восстановителей, а малопрочные оксиды – в качестве окислителей;
-у углерода сродство к кислороду с ростом температуры повышается, значит, его можно использовать в качестве универсального восстановителя, с его помощью можно восстанавливать любой оксид, если будет достигнута соответствующая температура.
Подобная графическая зависимость существует и для сульфидов и для галогенидов, однако, в таком случае, все линии  располагаются в области менее отрицательных значений
располагаются в области менее отрицательных значений  .
.
Термодинамика восстановительной реакции может быть оценена следующим образом:
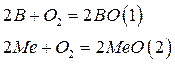 Где В – восстановитель.
Где В – восстановитель.



Если  реакции восстановления выразить через
реакции восстановления выразить через  реакции (1) и (2), тогда
реакции (1) и (2), тогда


Величины  и
и  сами по себе являются отрицательными, а это означает, что
сами по себе являются отрицательными, а это означает, что  будет меньше нуля, если
будет меньше нуля, если  Х будет более отрицательно, чем величина
Х будет более отрицательно, чем величина  .
.
Таким образом, если выбрать в качестве восстановителя вещество с более высоким сродством к кислороду (  будет более отрицательно), тогда будет заведомо известно, что реакция восстановления может идти вправо. Насколько полно будет идти данный процесс, зависит от различия в сродстве к кислороду у металла и восстановителя: чем это различие больше, тем реакция восстановления идет лучше. И, наоборот, если
будет более отрицательно), тогда будет заведомо известно, что реакция восстановления может идти вправо. Насколько полно будет идти данный процесс, зависит от различия в сродстве к кислороду у металла и восстановителя: чем это различие больше, тем реакция восстановления идет лучше. И, наоборот, если  будет больше нуля, тогда реакция восстановления невозможна, и место имеет окислительный процесс.
будет больше нуля, тогда реакция восстановления невозможна, и место имеет окислительный процесс.
Тот же характер носят и реакции восстановления (окисления) металлов из сульфидов и галогенидов.
Дата добавления: 2015-04-21; просмотров: 963; Мы поможем в написании вашей работы!; Нарушение авторских прав |