
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 9.Подвижность химического равновесия. Принцип Ле Шателье. Уравнение изохоры и изобары Вант- Гоффа.
Под внешними факторами будем понимать любые взаимодействия на систему, в результате которых изменяется ее температура и число частиц в единице объема пространства (этот фактор обычно рассматривают как влияние давления).
Если система находится в химическом равновесии, то это значит, что ее в любом элементарном объеме имеет место одна и та же температура. Одно и то же давление и определенный химический состав. Правильнее говорить, что система находится в термодинамически устойчивом состоянии. Если изменится температура и давление, то система обязательно изменит и свой химический состав и перейдет в новое химическое равновесие.
Качественно подвижность равновесия в связи с изменением давления и температуры впервые установил Ле Шателье, а затем существенно дополнил и развил Браун.
ПРИНЦИП ЛЕ ШАТЕЛЬЕ – БРАУНА.
Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то она перейдет в новое равновесное состояние, в котором это воздействие будет ослаблено.
Влияние температуры:


При новой, более высокой температуре равновесие смещается влево. При повышении температуры системы увеличивается доля веществ, образующихся по реакции, протекающей с поглощением тепла.


Влияние давления:
При повышении давления равновесие смещается в ту сторону, где возрастает доля веществ, имеющих меньший порциальный объем.

Количественно влияние температуры на подвижность равновесия устанавливается с помощью уравнений изохоры или изобары Вант Гоффа.



Уравнения изохоры и изобары показывают, что количественно зависимость константы равновесия от температуры может быть выражена через тепловой эффект химических реакций, а более детально можно указать на следующее:
1.Допустим, что dT>0 , значит рассматриваем как изменится константа равновесия при повышении температуры. Если  (реакция эндотермическая), то с повышением температуры константа равновесия увеличится. Если
(реакция эндотермическая), то с повышением температуры константа равновесия увеличится. Если  (реакция экзотермическая), то с повышением температуры константа равновесия уменьшится. Имея ввиду, что в константе равновесия числитель – это всегда концентрация продуктов, то рост Кр означает смещение равновесия вправо, и, соответственно, уменьшение Кр – смещение равновесия влево.
(реакция экзотермическая), то с повышением температуры константа равновесия уменьшится. Имея ввиду, что в константе равновесия числитель – это всегда концентрация продуктов, то рост Кр означает смещение равновесия вправо, и, соответственно, уменьшение Кр – смещение равновесия влево.
2.Абсолютная величина теплового эффекта говорит о том, как сильно изменяется константа равновесия от температуры, чем больше по абсолютной величине 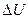 или
или  , тем сильнее изменяется константа равновесия с изменением температуры. У слабо экзо- или эндореакций константа равновесия с изменением температуры практически не меняется.
, тем сильнее изменяется константа равновесия с изменением температуры. У слабо экзо- или эндореакций константа равновесия с изменением температуры практически не меняется.
3.Уравнения позволяют рассчитать константу равновесия для любой температуры, если Кр известна при какой-то другой температуре. Интегрируя уравнения изохоры или изобары получим:


4.Нередкими являются случаи, когда полученное уравнение используют для нахождения теплового эффекта реакции. В этом случае реакцию проводят при 2х разных температурах, отбирают пробы веществ, анализируют и находят равновесные концентрации, вычисляют константы равновесия Кр(Т1) и Кр(T2), затем находят тепловой эффект:

Уравнения изохоры и изобары являются приближенными, их удобно использовать для реакций, в которых между Т1 и Т2 ни одно из веществ не претерпевает превращений и в тех случаях, когда интервал между температурами Т1 и Т2 не очень широк.
Дата добавления: 2015-04-21; просмотров: 1099; Мы поможем в написании вашей работы!; Нарушение авторских прав |