
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 13.Теоретические основы процессов раскисления стали.
Раскисление –это процесс удаления из металла избыточного кислорода.
Большинство металлов в жидком виде хорошо растворяют кислород. С повышением температуры растворяемость кислорода увеличивается.
 - эндотермическая реакция
- эндотермическая реакция 
 - экзотермическая реакция
- экзотермическая реакция 
 - эндотермическая реакция
- эндотермическая реакция
В процессе окислительного рафинирования металл максимально насыщают кислородом количество которого становится, в конце концов, адекватным концентрации примесей. Оставшийся кислород становится сам вредной примесью. Причинами этого является следующее:
1.При охлаждении металла растворимость кислорода в нем понижается, кислород выделяется в виде разных по размерам газовых пузырей. Часть пузырьков успевает выйти в атмосферу, а часть – остается в слитках в виде газовых раковин, и при обработке давлением она препятствует свариванию металла.
2.Т.к. реакции окисления примесей идут лучше при более низких температурах, то оставшиеся в металле примеси и кислород при охлаждении снова начинают между собой реагировать, образуя твердые оксидные включения, которые называют неметаллическими. Эти включения снижают металлические свойства изделий.
3.Часть газовых пузырей в металле образуется по причине реагирования растворенных углерода и кислорода с образованием газообразного СО. 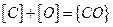
4.Часть кислорода остается в металле в твердом растворе, она не успевает не образовывать газовых пузырей, не прореагировать с примесями.
Затвердевшие растворы являются пересыщенными, а все пересыщенные растворы – неустойчивы, и со временем они распадаются. Это приводит к образованию мельчайших газовых пор. Все процессы распада пересыщенных растворов в науке и технике называют процессами «старения».
Избыточный кислород удаляют с помощью веществ, называемых раскислителями. В качестве раскислителей применяют чистые вещества или сплавы с высоким сродством к кислороду. (Обычно это Mn, Si, Al, FeMn, SiMn, FeSi, SiCa и др.).
Общие термодинамические принципы раскисления рассмотрим на примере реакции:
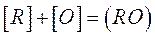
Где  - кислород, растворенный в металле;
- кислород, растворенный в металле;
 - раскислитель.
- раскислитель.
Константа равновесия этой реакции имеет вид:

Для определения факторов, влияющих на остаточную концентрацию кислорода, запишем выражение для остаточной концентрации кислорода в следующем виде
Итак, видим, чтобы концентрация кислорода в металле была минимальной необходимо:
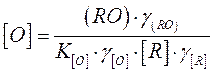
1.Концентрация оксида в шлаке должна быть малой, т.е. шлака должно быть достаточно. При раскислении шлак обычно периодически скачивают.
2.Коэффициент активности оксидов примесей должен быть малым, для этого необходимо, чтобы оксид раскислителя в шлаке был связан в устойчивые комплексы или устойчивые химические соединения, Если раскислителем является марганец, то им удобно раскислять под кислым шлаком, если раскислителем является кремний – под основным шлаком.
3.Константа равновесия должна быть большой. Ее величина зависит от средства раскислителя к кислороду и температуры. Чем выше сродство раскислителя к кислороду, тем выше 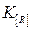 , значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше.
, значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше.
Реакции взаимодействия раскислителя с кислородом являются экзотермическими, т.е. с повышением температуры константа понижается и , наоборот. Значит, раскислять необходимо при умеренных температурах, металл не должен быть перегрет.
4.Коэффициент активности кислорода считается const
5.Концентрация раскислителя в жидком металле должна быть достаточной, но при этом раскислитель сам не должен стать вредной примесью.
6.Коэффициент активности раскислителя является величиной малорегулируемой, и ее обычно не учитывают.
Раскисление можно осуществлять двумя методами.
Осаждающий метод заключается в том, что в расплавленный металл задается пусковой раскислитель, раскислитель растворяется в металле и вступает в реакцию с растворенным кислородом во всем объеме жидкого расплава. Этот метод применяют только для случаев, когда кислород способен в большей или меньшей мере растворяться в металле.
Диффузионный метод основан на законе распределения кислорода между металлом и шлаком. В этом методе порошкообразный раскислитель задается на поверхность шлака. Раскислитель взаимодействует с малопрочными оксидами шлака и переводит их в прочные оксиды. Концентрация кислорода в шлаке остается неизменной, но коэффициент активности кислорода в шлаке уменьшается. Т.к. коэффициент распределения кислорода для заданной системы и температуры – величина постоянная, то это приводит к тому, что кислород из металла переходит в шлаковую фазу, где снова связывается с раскислителем в прочные оксиды. Этот метод пригоден для удаления кислорода из металлов, хорошо растворяющих в себе кислород, а также металлов, которые плохо растворяют его в себе. Существенным недостатком данного метода является малая скорость процесса.
Дата добавления: 2015-04-21; просмотров: 365; Мы поможем в написании вашей работы!; Нарушение авторских прав |