
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 7.Химическое равновесие и константа равновесия металлургических процессов. Равновесные концентрации.
После начала реакции химический потенциал одних веществ уменьшается, других – увеличивается, наступает их равенство, а значит и химическое равновесие.
В равновесном состоянии  реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.
реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.
Для равновесного состояния можно записать:

и константа равновесия равна: 
В случае, если Кр>1 – это означает, что продуктов реакции больше, чем исходных веществ, если Кр<1, то соответственно, наоборот. Если же Кр=1, то концентрации веществ при равновесии соизмеримы.
По величине константы равновесия можно качественно судить о полноте протекания процесса. Помимо этого, зная величину Кр, можно рассчитать равновесные концентрации для большинства 2х и более компонентных смесей. В равновесной системе устанавливается постоянное соотношение между микрочастицами различных веществ участников реакции. Плотность материальных частиц и их энергий по объему системы или по отдельным фазам устанавливается постоянной. Константа равновесия, вычисляемая из уравнения (1), обязательно должна выражаться или через парциальное давление, или через активность веществ в растворе, или через то и другое. В то же время, концентрации веществ, особенно газов, часто удобно выражать другими величинами: через мольные доли, объемные проценты, молярность (число молей на литр). В этих случаях для одной и той же реакции в цифровом отношении константы могут отличаться, но между ними, естественно, существует взаимосвязь.
Пример: 


 - Равновесные парциональные давления веществ в газовой смеси.
- Равновесные парциональные давления веществ в газовой смеси.
 - общее давление смеси.
- общее давление смеси.
Выразим константу равновесия через мольные доли. В равновесном состоянии имеем  соответственно
соответственно  общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе
общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе

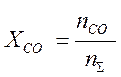
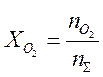

Связь между парциальными давлениями и молными долями имеет вид:
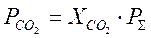


Из данных зависимостей найдем:
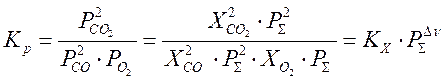
Таким образом, связь между константой равновесия, выраженной через парциальные давления, и константой равновесия, выраженной через мольные доли, носит следующий характер:

 - разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:
- разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:

Найдем константу равновесия через объемные проценты:




Таким образом, связь между Kp и Kc выглядит так: 
Найдем константу равновесия через молярность:
Используем равенство  ,
,
где 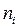 количество молей вещества,
количество молей вещества,
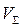 общий объем, выраженный в литрах.
общий объем, выраженный в литрах.
Тогда 
Для каждого газа в равновесной системе имеем:




Таким образом, связь между Кр и Кс имеет вид: 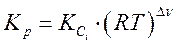
Итак, взаимосвязь между константами равновесия выглядит следующим образом:

Дата добавления: 2015-04-21; просмотров: 718; Мы поможем в написании вашей работы!; Нарушение авторских прав |