
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 6.Химические реакции металлургических процессов. Оценка самопроизвольности их протекания. Уравнение изотермы Вант- Гоффа.
Причинами реагирования веществ между собой являются:
-наличие у веществ определенных химических потенциалов;
-неодинаковость (различие) значений этих химических потенциалов у веществ-реагентов и веществ-продуктов.
Реакция может идти при заданной температуре только в направлении образования менее активных веществ из более активных. Условием возможности протекания процесса вправо или влево является неравенство химических потенциалов участников реакции:
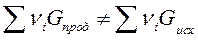
Если,  то реакция может идти вправо.
то реакция может идти вправо.
 для любой реакции рассчитывается так: от потенциала веществ продуктов реакции вычитают химические потенциалы исходных веществ.
для любой реакции рассчитывается так: от потенциала веществ продуктов реакции вычитают химические потенциалы исходных веществ.
Рассмотрим пример:
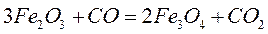

Fe3O4 и Fe2O3 являются чистыми конденсированными веществами, их химические потенциалы считаются стандартными и обозначаются: 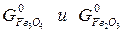
Газы до начала реагирования могут иметь разные парциальные давления, их химические потенциалы зависят от давления при постоянной температуре:
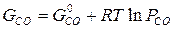
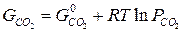
Тогда, 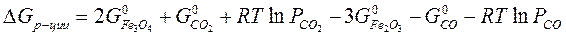
Величины 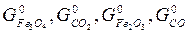 для каждой определенной температуры являются строго определенными, их разность при заданной температуре всегда одна и та же.
для каждой определенной температуры являются строго определенными, их разность при заданной температуре всегда одна и та же.
Таким образом, имеем:
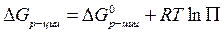 -уравнение изотермы Вант-Гоффа
-уравнение изотермы Вант-Гоффа
где 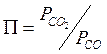 в данном случае.
в данном случае.
В общем случае П – это отношение концентраций веществ-продуктов, вступающих в реакцию, с соответствующими показателями степеней, равным коэффициентам в исходном состоянии.
Уравнение изотермы Вант-Гоффа показывает, что возможность протекания реакции вправо или влево зависит от:
-природы веществ-участников реакции;
-температуры, которая фигурирует в двух слагаемых и 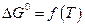 и
и 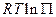 . Степень влияния зависит как от состава химической системы, так и от исходного состояния;
. Степень влияния зависит как от состава химической системы, так и от исходного состояния;
-исходного состояния веществ. Суть этого влияния заключается в том, с какой стороны от равновесия находится смесь веществ-реагентов. Переход к равновесию от исходного состояния соответственно может быть связан с протеканием реакции вправо или влево.
Дата добавления: 2015-04-21; просмотров: 322; Мы поможем в написании вашей работы!; Нарушение авторских прав |