
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вопрос № 5. Энтропийный метод расчёта константы равновесия химических реакций.
Общий запас внутренней энергии каждого вещества вычисляют по уравнению:

Для расчета химических реакций используют понятие о химическом потенциале:

Энтропийный метод расчета  основан на следующем:
основан на следующем:


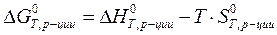
Вариантов расчета теплового эффекта реакции и изменения энтропии существует несколько. Есть способ, когда непосредственно по справочным данным величину  реакции рассчитывают так:
реакции рассчитывают так:


Приведенные уравнения показывают, как может изменяться внутренняя энергия и энтропия произвольного вещества при изменении его температуры. В реакции участвуют разные вещества и для каждого из них, в зависимости от наличия или отсутствия модификационных и агрегатных превращений, зависимость внутренней энергии или энтропии от температуры может выражаться разными уравнениями. Например, если какое-либо вещество не претерпевает никаких изменений в интервале температур от 298 до Т, то для такого вещества:
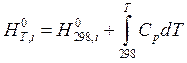 соответственно
соответственно 
В случае, если вещества претерпевают изменения в интервале температур от 298 до Т, величины 
 можно найти так:
можно найти так:


Рассмотрим качественный пример:




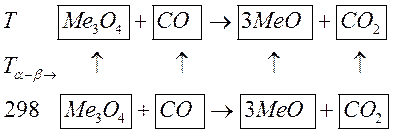
Итак, видим, что только одно вещество-участник реакции претерпевает превращение при  , значит весь интервал расчета разбиваем на два промежутка: от
, значит весь интервал расчета разбиваем на два промежутка: от 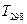 до
до  и от
и от  до искомой температуры. Получаем:
до искомой температуры. Получаем:


Так как теплоемкость у каждого вещества зависит от температуры, следующим образом  , то
, то  и
и 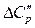 находятся для каждого температурного интервала с учетом тех значений и коэффициентов
находятся для каждого температурного интервала с учетом тех значений и коэффициентов  , которые справедливы для веществ в заданном интервале:
, которые справедливы для веществ в заданном интервале:

где 



где 

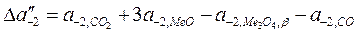
Подинтегральные выражения в уравнениях  и
и  в общем случае берутся так:
в общем случае берутся так:


 находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.
находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.

Если в реакции участвует простое вещество, то теплота его образования 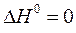
 находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.
находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.

Итак, вычисляем  и
и  , затем по уравнению (1) находим
, затем по уравнению (1) находим  , а потом из уравнения
, а потом из уравнения 
Находим константу равновесия.

Дата добавления: 2015-04-21; просмотров: 303; Мы поможем в написании вашей работы!; Нарушение авторских прав |