
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методы фракционирования (разделения) белков
После экстракции смеси белков из биологического материала проводят ее разделение на индивидуальные фракции белков. Разработано несколько методов фракционирования белков, основанных на различных физико-химических свойствах белков.
– осаждение белков в изоэлектрической точке – в основе метода лежит свойство белков в изоэлектрической точке выпадать в осадок вследствие нейтрализации заряда белковой молекулы. Для каждого белка значение изоэлектрической точки строго индивидуально, поэтому данным методом возможно выделение индивидуальных белков (подробнее о методе см. лабораторную работу №3 в курсе «Биохимия»).
– фракционирование белков методом высаливания – основано на различной растворимости белков в концентрированных растворах нейтральных солей, в зависимости от молекулярной массы (подробнее о методе см. лабораторную работу №3 в курсе «Биохимия»).
– метод электрофоретического разделения белков на фракции – описан в разделе физико-химические свойства белков.
Кроме представленных выше методов для разделения белков на фракции широко используют хроматографические методы. Чаще всего используют колоночную хроматографию.
Особенностью данного метода является то, что смесь молекул различных белков и пептидов пропускают через колонку, содержащую твердый пористый материал (матрикс). В результате взаимодействия с матриксом различные белки проходят через колонку с различной скоростью. После того как белки достигнут в определенной последовательности дна колонки, их собирают отдельными фракциями в пробирки.
Выделяют три основных вида колоночной хроматографии:
– ионообменная – для хроматографии белков применяют ионообменники на основе целлюлозы или других гидрофильных полимеров, например, диэтиламиноэтилцеллюлозу (ДЭАЭ-целлюлоза), содержащую катионные группы (отрицательный заряд) или содержащую карбоксиметилцеллюлозу (КМ-целлюлоза), содержащую аминные группы (положительный заряд):
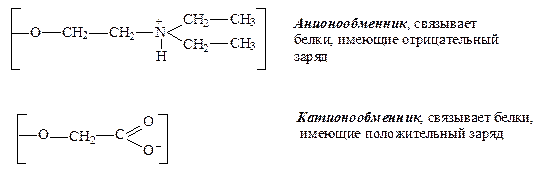
Прочность связывания белков с ДЭАЭ-целлюлозой тем выше, чем больше в молекуле белка карбоксильных групп. Белки, адсорбированные на ДЭАЭ-целлюлозе, можно смыть (элюировать) из колонки растворами с возрастающей концентрацией хлорида натрия. Вначале элюируются слабосвязанные белки, а по мере увеличения концентрации соли и другие белки, в порядке возрастания их сродства к ДЭАЭ-целлюлозе.
Аналогично применяют и КМ-целлюлозу, но сродство белков к ней прямо пропорционально числу аминогрупп в молекуле белка.
Для снятия связанного белка также изменяют рН элюента.
– хроматография гель-фильтрацией – имеет второе название «метод молекулярных сит». В качестве сит используют сефадекс (полисахарид декстран, обработанный эпихлоридгидрином). Зерна сефадекса набухают в воде и образуют гель. Набухшие гранулы имеют поры определенного диаметра.
Разделение основано на том, что зерна сефадекса (поры гранул) непроницаемы или ограничено проницаемы для веществ с большой молекулярной массой, а небольшие молекулы свободно диффундируют (проникают) в поры зерен.
Гелеобразную массу набухшего сефадекса помещают в стеклянную колонку (трубку), на поверхности геля наносят слой белкового раствора (рис. 12, а) и затем через колонку пропускают буферный раствор (элюирующая жидкость). Белки проходят вдоль колонки между гранулами тем медленнее, чем меньше их молекулярная масса, так как молекулы белков с еще меньшей молекулярной массой легче диффундируют внутрь гранул (в поры) (рис. 12).

Рис. 12. Фракционирование белков методом гель-фильтрации
Белки вымываются (элюируются) из колонки в порядке убывания молекулярной массы. Следовательно, первыми элюируются крупные белковые молекулы (рис. 12, б), которые не диффундируют в зерна, затем мелкие молекулы и в последнюю очередь низкомолекулярные примеси.
Этот метод применяют не только для фракционирования белков по молекулярной массе, но и для очистки их от низкомолекулярных примесей.
– аффинная хроматография – или хроматография по сродству. Принцип метода заключается в том, что происходит избирательное взаимодействие белков со специфическими веществами – лигандами, закрепленными на носителях (рис. 13).
В качестве носителя используют активированную бромцианом сефарозу. К сефарозе присоединяют лиганды различного происхождения – субстрат, или антиген, или рецептор, которые будут афинно связывать только один белок из смеси:
– субстрат → фермент;
– антиген → антитело;
– гормон → рецептор данного гормона.
Другие белки, не связавшиеся с лигандом, удаляются путем промывания колонки.

Рис. 13. Механизм аффинной хроматографии
Снятие с колонки афинно закрепленного белка осуществляется с помощью буферного раствора (элюента). В состав буфера вводят детергент, который ослабляет связи между белком и лигандом, или через колонку пропускают раствор с высокой концентрацией свободного лиганда. В этом случае белок легче связывается со свободным лигандом и вымывается (элюируется) из колонки.
Дата добавления: 2015-02-09; просмотров: 763; Мы поможем в написании вашей работы!; Нарушение авторских прав |