
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Простые белки
К этой группе белков относят гистоны, протамины, альбумины, глобулины, проламины, глютелины и протеиноиды (α-кератин, фиброин, коллаген, эластин).
Гистоны – тканевые белки многоклеточных организмов, локализованы в ядре клеток. Представляют собой низкомолекулярные (Мм 11000–24000) белки с третичной структурой, обладают выраженными основными свойствами (рI 9,5–12), т.к. содержат большое количество аргинина и лизина.
Гистоны прочно связаны с ДНК хроматина (связь ионная). Выделяют пять фракций гистонов (методом электрофореза в полиакриламидном геле, ПААГ). Разделение на фракции зависит от соотношения в них аргинина и лизина.
Основные функции гистонов – структурная и регуляторная:
– структурная – гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно хроматина, хромосом и нуклеосом;
– регуляторная – заключается в способности блокировать передачу генетической информации от ДНК к РНК (транскрипцию) (рис. 14).

Рис. 14. Транскрипция ДНК
Участки ДНК, связанные с гистонами, не могут подвергаться транскрипции. Там, где ДНК свободна от гистонов, двойная спираль расплетается и освободившийся участок ДНК подвергается транскрипции.
Протамины – самые низкомолекулярные белки (Мм 4000–12000). Резко выражен основный характер, так как содержат до 80% аргинина. Протамины связывают ДНК в хроматине спермиев и делают ее компактной. Выполняют главным образом структурную функцию, поэтому и присутствуют в клетках не способных к делению.
Альбумины и глобулины – содержатся в плазме крови, в клетках тканей, молоке, клетках растений, зерне и др. Они разнообразны по структуре, физико-химическим свойствам и биологической роли.
Альбумины – белки с Мм 15000–70000, следовательно, это мелкодисперсные белки. Имеют выраженный кислый характер (рI 4,7) так как содержат большое количество аспарагиновой и глутаминовой кислот. Хорошо растворимы в воде.
Биологические функции альбуминов:
1. Трофическая (питательная) – альбумин куриного яйца (овальбумин), молока (лактальбумин), зерновых культур и другие.
2. Транспортная – альбумины обладают высокой адсорбционной способностью (адсорбируют полярные и неполярные молекулы). Например, альбумины крови транспортируют жирные кислоты от жирового депо к другим органам и тканям.
3. Обезвреживающая – альбумины связывают токсичные соединения – алкалоиды, тяжелые металлы, билирубин.
4. Альбумины обеспечивают на 80% осмотическое давление крови от всех других сывороточных белков.
Глобулины – это слабокислые или нейтральные белки (рI 6,0–7,3), Мм >100000. Они нерастворимы в воде, но растворяются в слабо-солевых растворах нейтральных солей (например, 0,9% NaCl), поэтому мало гидратированы.
Глобулины являются неоднородными белками. При электрофорезе на хроматографической бумаге их можно разделить в зависимости от электрофоретической подвижности на 4 фракции: α1-, α2-, β-, γ-глобулины.
Биологические функции глобулинов:
1. Транспортная – в крови глобулины транспортируют холестерин, фосфолипиды, триглицериды, гаптоглобин, церулоплазмин, трансферрин, ионы железа (Fe2+), меди (Cu2+), витамин В12. В молоке лактоглобулины и лактальбумины также выполняют транспортную функцию.
2. Гемостатическая – β-глобулины содержат протромбин (свертывающая система)
3. Защитная – фракция γ-глобулинов представлена смесью различных иммуноглобулинов. α1-глобулины транспортируют острофазовый белок α1-кислый гликопротеин.
4. Трофическая – глобулины составляют основную часть запасных белков семядолей бобовых культур (сои, гороха, фасоли, вики), алейроновых зерен масличных культур (подсолнечника, хлопчатника, льна, горчицы) и овощных культур.
5. Альбумины и глобулины зародыша и алейронового слоя выполняют каталитическую (ферментативную) функцию при прорастании зерна и в технологических процессах.
Проламины – белки растительного происхождения, содержатся в клейковине семян злаковых растений. В их состав входит большое количество глутамина (14–43%), пролина (6,3–19,0%) и малое количество ионогенных групп (дикарбоновые аминокислоты почти полностью амидированы, RCONH2). Проламины отличаются низким содержанием лизина. Очень мало его в зеине кукурузы (0,2%), глиадине пшеницы и секалине ржи (0,6–0,7%). Высокий процент лизина (3,3%) наблюдается в авенине овса (перечислены названия проламинов различных злаковых культур). Проламины также бедны треонином, триптофаном, аргинином и гистидином. Зеин кукурузы, оризин риса, кафирин сорго отличаются высоким содержанием лейцина (16,9–18,6%). По содержанию метионина выделяют глиадин пшеницы – 1,2%, авенин овса – 3,7%.
Небольшое количество указанных аминокислот в проламинах компенсируется относительно большим содержанием данной фракции в суммарном белке большинства злаков.
Проламины нерастворимы в воде, солевых растворах, кислотах и щелочах. Они растворяются в 70%-ном спирте, что связано с наличием большого количества неполярной аминокислоты пролина.
Проламины практически отсутствуют в бобовых и масличных культурах.
Глютелины – растительные белки, растворимые в щелочах, что объясняется большим содержанием аргинина. Они занимают промежуточное положение между проламинами и глобулинами. Содержание лизина, аргинина, и гистидина в них больше чем в проламинах. Так, содержание лизина в глютелине пшеницы составляет 2,6%, в глютелине ржи – 2,3%, ячменя – 4,0%, овса – 5%. Глютелины ячменя, риса и овса отличаются от глютелина пшеницы (глютенина) более высоким уровнем лизина. Например, у риса 80% всего белка приходится на глютелины (оризенин), этим можно объяснить удовлетворительное содержание лизина (2,6–4,0%) в общем белке рисового зерна. Преобладающими фракциями овса являются глобулины и глютелины, содержащие 5–5,5% лизина, что также обеспечивает хорошую сбалансированность данной культуры по лизину.
Протеиноиды – белки опорных тканей (костей, хрящей, связок, сухожилий, ногтей, волос, эпидермиса кожи).
Это фибриллярные белки, имеют β-конфигурацию полипептидных цепей, молекулы которых образуют многомолекулярные нитевидные комплексы – фибриллы. Самые распространенные в природе: фиброин, коллаген, кератин, эластин. Они могут иметь третичную и четвертичную структуры. Протеиноиды нерастворимы в воде – только в специальных растворителях. Не перевариваются в желудочно-кишечном тракте большинства животных и человека. Однако, некоторые членистоногие приспособились к питанию фибриллярными белками кожи, перьев птиц, шерсти (например, моль).
Характеристика представителей протеиноидов:
Фиброин – белок шелка. Его β-структура состоит из антипараллельных полипептидных цепей, связанных между собой водородными связями.
α-Кератин – составляет эпидермис кожи, волосы, ногти, рога. Полипептидные цепи этих белков имеют конформацию α-спирали. В волосе три такие цепи, скрученные в суперспираль, образуют протофибриллу. Несколько протофибрилл вновь образуют спиральный жгут – микрофибриллу. Жгут из микрофибрилл образует макрофибриллу. Многожильный канат одного волоса содержит сотни макрофибрилл. Молекулы α-кератина ориентированы параллельно и соединены дисульфидными связями (содержат много цистеина), что придает прочность структуре.
Коллаген – самый распространенный белок в мире животных. Он составляет 1/3 от общего количества белка позвоночных. Более 80% всего коллагена организма находится в межклеточном веществе соединительной ткани кожи, костей, связок, сухожилий, хрящей. Эти ткани обладают малой растяжимостью и высокой прочностью.
Полипептидная цепь коллагена содержит приблизительно 1000 аминокислот. Она построена из повторяющейся тройки аминокислот – гли-А-В, где А и В чаще всего представлены пролином или гидроксипролином. На долю глицина приходится 30%, пролина и гидроксипролина – 20%, аланина – 10%, остальных аминокислот – 40%. Коллаген единственный белок, в состав которого входит гидроксипролин.
Полипептидные цепи коллагена при формировании вторичной и третичной структуры не могут давать типичные α-спирали, так как этому мешают антиспиральные аминокислоты – глицин, пролин и гидроксипролин (они не образуют достаточного количества водородных связей).
Три α-цепи коллагена ориентированы параллельно и перевиты между собой, образуя субъединицу – тропоколлаген (микрофибриллу), представляющий собой плотный жгут:

Между полипептидными цепями микрофибрилл (тропоколлагена) образуются водородные, гидрофобные и ионные связи.
Из тропоколлагена формируется четвертичная структура. Молекулы тропоколлагена сшиваются между собой поперечными ковалентными связями за счет аминогрупп радикалов лизина в более толстые коллагеновые фибриллы, а из них затем образуются волокна и пучки волокон:
 Тропоколлаген
Тропоколлаген
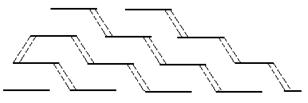
В ходе образования коллагена (созревания) многие остатки пролина и лизина гидроксилируются при участии аскорбиновой кислоты, которая выступает в качестве кофактора:

Витамин С необходим для поддержания в восстановленном состоянии ионов Fe2+ в активном центре фермента пролилгидроксилазы и для активации (восстановления) кислорода:

При авитаминозе С нарушается формирование прочной структуры коллагена, что приводит к разрыхлению соединительной ткани.
Помимо ковалентных свзей три спирально навитые друг на друга молекулы тропоколлагена в структуре коллагеновых фибрилл имеют дополнительную стабилизацию, которую формируют водородные связи при участии гидроксилированных остатков лизина и пролина.
Например, сухожилия представляют собой пучки параллельно ориентированных коллагеновых фибрилл. В отличие от сухожилий, в коже коллагеновые фибриллы образуют подобие неупорядоченной двухмерной сетки.
Пустоты в коллагеновых фибриллах могут служить местом первоначального отложения кристаллов гидроксиапатита – Са5(ОН)(РО4)3, играющего важную роль в минерализации костей.
Известно несколько типов коллагенов, различающихся структурой полипептидных цепей, укладкой их во вторичную третичную и четвертичную структуры, степенью гликозилирования.
Генетически обусловленные нарушения созревания коллагена после синтеза его полипептидных цепей на рибосомах приводит к тяжелым наследственным заболеваниям – коллагенозам.
Все гликозаминогликаны (гетерополисахаридные цепи протеогликанов), содержащие уроновые кислоты и сульфатные группы при нейтральных значениях рН электростатически связываются с коллагеном. С каждым коллагеновым мономером связывается от 2 до 5 хондроитинсульфатных цепей протеогликанов. С эластином также специфически связываются хондроитинсульфаты и гепарансульфаты
Эластин – содержится в больших количествах в межклеточном веществе соединительных тканей, испытывающих периодические растяжения и сокращения. Это гладкие мышцы крупных кровеносных сосудов, связок, легких.
Например, в аорте эластин составляет 30–60% от массы вещества ткани, в выйной связке – 70–80%.
Структура эластина менее изучена. Как и коллаген, эластин содержит много глицина (30%) и аланина (21%), но мало гидроксипролина и нет гидроксилизина. В его состав входят также лейцин (10%), лизин (10%), валин (13%) и другие гидрофобные аминокислоты.
Эластин основной компонент эластических волокон соединительной ткани, резиноподобный полимер.
Он содержит обычные α-спирали, но благодаря некоторым особенностям строения молекулы эластина обладают упругостью большей, чем резина. Эластин образует поперечно-сшитую сеть, которая своими необычными механическими свойствами обязана уникальному способу ковалентного связывания боковых цепей лизина: четыре сближенных лизиновых остатка ферментативно формируют так называемую десмозиновую структуру, объединяющую в один узел четыре участка полипептидных цепей:

Организованные таким образом полипептидные цепи тропоэластина могут соединяться в системы, способные обратимо растягиваться во всех направлениях.
Эластин не растворяется в холодной и горячей воде, в солевых растворах, разведенных кислотах и щелочах. Даже крепкая серная кислота оказывает на него слабое действие. Из эластина не образуется желатин. Изоэлектрическая точка смещена в слабокислую сторону, поскольку незначительно преобладают кислые аминокислоты. В водной среде полипептидные цепи эластина принимают форму глобулы, которая окружена гидратной оболочкой. Гидрофобные радикалы аминокислот, образующие соответсвующие связи, спрятаны внутри белковой молекулы.
Эластин не переваривается трипсином и химотрипсином, очень медленно гидролизуется пепсином в кислой среде при рН 2. В тонком кишечнике эластин расщепляется эластазой поджелудочной железы до аминокислот, пептидов и поперечно-сшитых пептидов. В пищевой промышленности для интенсификации процессов обработки и созревания мяса (коллагена, эластина, миозина) применяют ферментные препараты растительного (папаин, фицин, бромелаин) и микробного происхождения.
Дата добавления: 2015-02-09; просмотров: 464; Мы поможем в написании вашей работы!; Нарушение авторских прав |