
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
V. Основные процессы дыхательной цепи
Процесс дыхания клеток включает несколько стадий:
1) Окисление с образованием ацетил-КоА из ПВК, ВЖК и аминокислот.
2) Разрушение ацетильных групп в цикле Кребса с высвобождением CO2 и накоплением водорода.
3) Стадия дыхания – перенос ē-в к молекулярному кислороду.
Эту стадию мы и рассмотрим в этом вопросе.
Структурная организация стадии дыхания в митохондриях очень сложна. Процессы дыхания протекают на внутренней мембране митохондрий. Ферментные системы, вовлечённые в транспорт ē-в по дыхательной цепи, весьма многочисленны.
В 1930 г. немецкие биохимики Кейлин и Варбург предположили, что процесс окисления водорода кислородом воздуха в дыхательной цепи идёт многостадийно, посредством электронных переносчиков. Они расположены вдоль дыхательной цепи в порядке возрастания их восстановительных потенциалов. Общий вид окислительно-восстановительных реакций можно представить следующим образом:

Каждая такая реакция характеризуется стандартным окислительно-восстановительным потенциалом, равным ЭДС, выраженной в вольтах, и возникающей на электроде, способном обратимо принимать ē от восстановителя, находящемся в равновесии с раствором, в котором восстановитель и окислитель присутствуют в концентрациях 1 моль/л при 250 С и рН = 7.
В качестве стандартного нулевого потенциала при этом принимают восстановительный потенциал реакции:

[H+] = 10–7 моль/л.
Во всех биохимических расчётах стандартный восстановительный потенциал системы E'0 = –0,42 В.
Некоторые стандартные окислительно-восстановительные потенциалы сопряжённых окислительно-восстановительных пар:
| Сопряжённые окислительно-восстановительные пары | Стандартные электродные потенциалы E'0, В | |

| –0,6 | |

| –0,32 | |

| –0,22 | |

| –0,19 | |
| Цитохромы: | b | +0,03 |
| c1 | +0,22 | |
| c | +0,25 | |
| a | +0,25 | |
| a3 | +0,39 | |

| +0,82 |
Данные приведены для двухэлектронного переноса, рН = 7, t = 250 С. Чем ниже стандартный окислительно-восстановительный потенциал, тем труднее восстанавливается окислитель.
Как известно, окислители и восстановители всегда функционируют как сопряжённые окислительно-восстановительные пары. В соответствии с предположениями Кейлина и Варбурга ē-ны субстрата (восстановителя) в первой окислительно-восстановительной реакции дыхательной цепи передаются к окисленной форме первого переносчика с участием фермента, который восстанавливается. Затем ē с восстановленной формы первого переносчика передаётся окисленной форме другого переносчика и т.д.
В результате 30-летних экспериментальных исследований были выделены дыхательные переносчики в митохондриях и сгруппированы в 4 группы:
1) пиридинзависимые дегидрогеназы;
2) флавинзависимые дегидрогеназы;
3) убихинон (кофермент Q);
4) цитохромы.
1) Пиридинзависимые дегидрогеназы катализируют восстановление окисленной формы коферментов НАД и НАДФ. К настоящему времени известно более 200 таких дегидрогеназ. Активаторами многих из них являются ионы двухвалентных металлов.
Впервые НАД был выделен Варбургом в 1933 г. Впоследствии исследования, проведённые Варбургом и другими учёными позволили установить механизм реакции восстановления НАД. Данный механизм является сложным и заключается в переносе двух атомов водорода, один из которых является протоном, а другой – гидрид-анионом. Первый присоединяется к молекуле НАД по месту наибольшей локализации отрицательного заряда, а второй – по месту с большой концентрацией положительного заряда.
Реакция восстановления НАД легко экспериментально прослеживается методом УФ-спектроскопии, поскольку НАД · Н2 по сравнению с НАД обладает слабой полосой поглощения при 440 нм, связанной с внутримолекулярным переносом заряда в биполярной структуре.

С восстановленной формой НАД · Н2 восстановительные эквиваленты (атом водорода и ē) переносятся на флавинадениндинуклеотид (ФАД) с помощью ферментов 2-й группы – флавинзависимых дегидрогеназ.
2) Флавинзависимые дегидрогеназы. Их коферментом является ФАД, в состав которого входит рибофлавин (витамин B2). Механизм реакции с участием флавинзависимых дегидрогеназ представляет собой прямой перенос пары атомов водорода от НАД · Н2 с образованием ФАД · Н2. Реакция, вероятно, протекает в две стадии. Вначале идёт перенос первого атома водорода с образованием так называемой семихинонной формы свободного радикала, а затем данная форма присоединяет второй электрон с атомом водорода и превращается в ФАД · Н2.
Данный процесс также можно изучить с помощью метода УФ спектроскопии, так как окисленные флавиновые дегидрогеназы интенсивно окрашены и их можно определить по полосе поглощения при 450 нм. При восстановлении ФАД эта полоса исчезает.
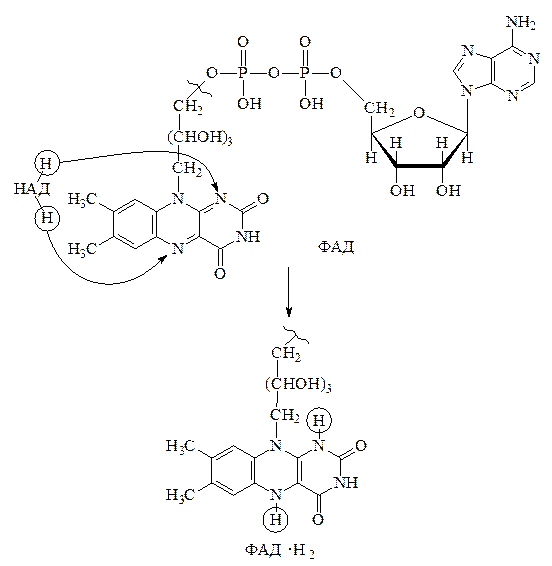
3) Кроме рассмотренных белковых компонентов в дыхательную цепь входит сравнительно малоизученный переносчик – убихинон, или кофермент Q, расположенный между флавиновой и цитохромной системами. Реакции с участием убихинона следующие:
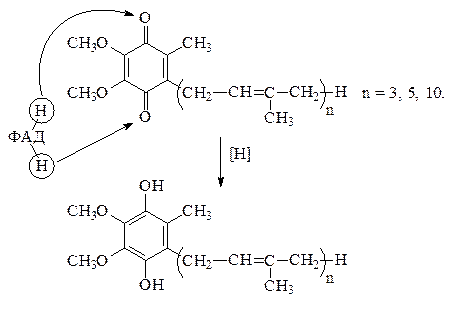
4) Цитохромы. Содержат железопорфириновую систему в качестве простетической группы (сходство с гемоглобином). Цитохромы переносят ē от восстановленного убихинона к молекулярному кислороду. В процессе переноса ē железо в железопорфириновой системе меняет свою степень окисленияот Fe+2 до Fe+3. Кислородом воздуха может окислять последний цитохром, называемый цитохромоксидазой.
Всего в митохондриях обнаружено 5 групп цитохромов, которые условно называются b, c, c1, a, a3. Только цитохром c был выделен в чистом виде, а другие цитохромы прочно связаны с мембраной митохондрий. Цитохромоксидазная система (a + a3) принимает ē от восстановленного цитохрома с и затем окисляется кислородом воздуха. Цитохромоксидазная система представляет собой комплекс из 6-ти субъединиц и имеет молекулярную массу 240 тыс. Да. Каждая из субъединиц содержит одну группу гемма A, а сам цитохром a3, который может реагировать с кислородом воздуха, состоит из 4-х субъединиц, которые кроме атомов Fe содержат атомы Cu. Процесс переноса ē на кислород сопровождается также окислением меди:
Cu+ – ē ® Cu2+
До сих пор не удалось создать дыхательную цепь из очищенных компонентов, так как огромную роль в функционировании цепи играют липиды внутренней мембраны митохондрий, которые образуют с ферментами надмолекулярные структуры. Такие структуры представляют собой единые функциональные единицы (дыхательные ансамбли). Предполагается, что каждая митохондрия в клетках печени содержит около 5 тыс. дыхательных ансамблей.
Кроме ферментов самой дыхательной цепи, в дыхательные ансамбли входят также ферменты, синтезирующие АТФ из АДФ за счёт энергии дыхательной цепи. Таким образом общая схема дыхательной цепи такова:
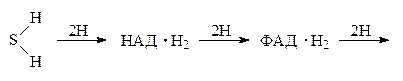

Дата добавления: 2015-02-09; просмотров: 558; Мы поможем в написании вашей работы!; Нарушение авторских прав |