
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Направление окислительно-восстановительных процессов
Пример
В кислый раствор, содержащий смесь солей КСl, КВr и KJ, добавлено достаточное количество КNO2. Записать редоксицепи, выражающие взаимодействие иона NO  по отдельности с галогенид–ионом. Сопоставлением электродных потенциалов установить, какой из галогенид–ионов будет окисляться до свободного состояния, а какие не будут. Для окисляющегося галогенид-иона написать молекулярные уравнения реакций.
по отдельности с галогенид–ионом. Сопоставлением электродных потенциалов установить, какой из галогенид–ионов будет окисляться до свободного состояния, а какие не будут. Для окисляющегося галогенид-иона написать молекулярные уравнения реакций.
Решение:
а) редоксицепь: NO 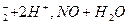 //2Cl–/Cl2
//2Cl–/Cl2
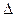 E= φ(окисл)–φ(вос-ля)
E= φ(окисл)–φ(вос-ля)
φ(2Сl–/Сl2)=+1,4 В
φ(NO  +2Н+/NO+Н2О)=+1,2 В
+2Н+/NO+Н2О)=+1,2 В
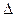 E=1,2 В – 1,4 В = – 0,2 В
E=1,2 В – 1,4 В = – 0,2 В
(ЭДС< 0, реакция не может протекать при н.у.)
б) редоксицепь: NO  + 2H+,NO + H2O//2Br– /Br2
+ 2H+,NO + H2O//2Br– /Br2
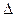 E= φ(окисл)–φ (вос-ля)
E= φ(окисл)–φ (вос-ля)
φ(2Br– /Br2)=+1,09 В
φ(NO  + 2H+/NO + H2O)=+1,2 В
+ 2H+/NO + H2O)=+1,2 В
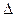 E= 1,2 В – 1,09 В = 0,11 В > 0
E= 1,2 В – 1,09 В = 0,11 В > 0
в) редоксицепь: NO  + 2H+,NO + H2O//2J,J2
+ 2H+,NO + H2O//2J,J2
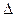 E= φ(окисл)–φ(вос-ля)
E= φ(окисл)–φ(вос-ля)
φ(2J/J2)= 0,53 В
φ(NO  + 2H+/NO + H2O)=+1,2 В
+ 2H+/NO + H2O)=+1,2 В
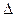 E= 1,2 В – 0,53 В = 0,67 В
E= 1,2 В – 0,53 В = 0,67 В
Протекает тот процесс, ЭДС которого больше нуля т.е. окисление КJ и КBr.
Уравнение реакции:
2КJ+2KNO2+4HCl  2NO
2NO  +2H2O+J2+4KCl
+2H2O+J2+4KCl
NO  + 2H+–1e– + 2H+–1e–  NO+H2O NO+H2O
| |
2J– – 2 e–  J2 J2
|
2NO  +4H+ +2 J–
+4H+ +2 J–  2NO + 2H2O + J2
2NO + 2H2O + J2
С КBr процесс аналогичен.
Задачи
111. В какую сторону пойдет реакция:
2KJ + PbO2 + 2HgSO4 = J2 + H2SO4 + PbSO4 + 2H2O
112. Определить, может ли ион Fe3+ окислить ион Cl–, Br–, J–, если учесть, что ион Fe3+ восстанавливается до Fe2+ ?
113. Определить, будет ли протекать реакция при взаимодействии 1М раствора FeSO4 и HgSO4 по схеме:
2FeSO4 + 2HgSO4 = Fe2(SO4)3 + Hg2SO4
114. Перманганат калия можно получить окислением манганата хлором K2MnO4 + Cl2 = KMnO4 + 2KCl. Можно ли вместо хлора использовать Br2 или J2?
115. Определить, может ли KMnO4 окислить NaJ в кислой среде?
116. Определить, будет ли MnO2 в кислом растворе окислять NaBr?
117. Может ли FeSO4 окисляться в Fe2(SO4)3 газообразным кислородом в кислой среде?
118. Сравните восстановительную способность Ca, Zn, Co, Cu по отношению к Cl2.
119. Определить, может ли оксид германия(IV) окислить Mn(NO3)2 в кислом растворе?
120. Определить, может ли KMnO4 окислить в кислой среде хлорид олова(II), если концентрация их раствора равна 1 моль/л.
121. Окислится ли в кислой среде ион Cr3+ в Cr2O  анионом NO
анионом NO  с восстановлением последнего до NO.
с восстановлением последнего до NO.
122. Какой окислитель Br2, H2O2 или HNO3 можно использовать в процессе: CrCl3 ® H2Cr2O7 ?
123. Какой окислитель Cl2, Br2 или J2 можно использовать в процессе Fe2+ ® Fe3+
124. Какой окислитель H2O2, PbO2 или K2Cr2O7 можно использовать в процессе: MnSO4 ® H2MnO4 ?
125. Какой окислитель Br2 или HNO3 можно использовать в процессе: H2SO3 ® H2SO4
126. Какой окислитель HClO, J2, или KMnO4 можно использовать в процессе: H2SeO3 ® H2SeO4 ?
127. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Cu2Cl2 + SnCl4 Û SnCl2 + 2CuCl2
128. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Na2SO3 + J2 + H2O Û Na2SO4 + 2HJ ?
129. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
2MnSO4+5Fe2(SO4)3+K2SO4+8H2OÛ2KMnO4+10FeSO4 +8H2SO4?
130. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
2Fe(OH)2 + Br2 + 2H2O Û 2Fe(OH)3 + 2HBr ?
131. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
HgO + Pb Û PbO + Hg ?
132. Определите направление протекания реакции, имея в виду, что активности окисленной и восстановленной форм равны:
Pb+Hg2SO4Û2Hg+PbSO4
133. Определите направление реакции при 25°C
2Fe(OH)2 + Br2 + 2H2O Û 2Fe(OH)3 + 2HBr,
если для системы Fe2+, Fe3+ aок : авосст = 10–6, а для системы 2Br–, Br2 аок : авосст=10–5
134. Определите направление реакции:
Cu2Cl2+SnCl4 Û 2CuCl2+SnCl2
при с(Cu+) = 0,002 моль/л; с(Cu2+) = 0,2 моль/л; с(Sn2+) = 0,003 моль/л; с(Sn4+) = 0,03 моль/л?
135. Будет ли окислять KMnO4 ионы Br– при а(Н+)=10–3 моль/л; а(MnО2+)=а(MnO  )=1 моль/л.
)=1 моль/л.
Дата добавления: 2015-04-16; просмотров: 412; Мы поможем в написании вашей работы!; Нарушение авторских прав |