
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Комбинированные задачи
211. Определите массовую долю (%) примесей в техническом карбиде кальция, если при полном разложении 1,8 кг образца водой образовалось 560 л ацетилена.
212. Определите массу Na2O2, вступившую в реакцию с водой, если общий объем полученного раствора NaOH 0,750 л, а 0,010 л этого раствора необходимо для нейтрализации 0,030 л 0,1 Н Hcl.
213. Вычислите тепловой эффект реакции: 2Mg+CO2  MgO+C,
MgO+C,
если известно, что  = –601,24 кДж/моль, а
= –601,24 кДж/моль, а  = –393,51 кДж/моль.
= –393,51 кДж/моль.
214. Найдите объем сероводорода, выделившегося при взаимодействии 60 г магния с 500 мл раствора серной кислоты (r = 1455 кг/м3) с массовой долей H2SO4 55,5% при температуре 180С и давлении 96 кПа.
215. Вычислите массу MgSO4  7H2O, содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
7H2O, содержащегося в 1 м3 раствора сульфата магния с массовой долей 20%. Плотность раствора 1219 кг/м3.
216. Определите массовую долю (%) разложившегося карбоната стронция, если при прокаливании 10 кг карбоната стронция его масса уменьшилась на 1,7 кг.
217. Смесь карбоната и гидроксида кальция, содержащую 45% карбоната кальция, обработали раствором соляной кислоты (r = 1200 кг/м3) с массовой долей Hcl 39%. Вычислите массу исходной смеси и объем соляной кислоты, вступившей в реакцию, если при этом выделилось 1,4 л газа (н.у.).
218. Рассчитайте количество теплоты, которое выделится при 250С при взаимодействии 12 г гидрида калия с водой, если  KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
KH и КОН соответственно равны –56,9 и –374,47 кДж/моль.
219. При растворении в кислоте 7,5 г оксида кальция, содержащего примесь карбоната кальция, выделилось 0,21 л газа (н.у.). Какова массовая доля (%) карбоната кальция в исходной смеси?
220. Магний раньше получали восстановлением хлорида магния с помощью натрия. Вычислить теплоту реакции, зная, что теплота образования MgCl2 равна 623,4 кДж, а теплота образования NaCl равна 409,5 кДж.
221. Хлор и водород, получаемые электролизом раствора NaCl, используют для производства соляной кислоты. Сколько кубических метров 18%-ного раствора поваренной соли (r=1,132 г/см3) должно быть подвергнуто электролизу, чтобы получить 1 т 30%-ного раствора соляной кислоты?
222. При прокаливании 30 г кристаллогидрата сульфата калия выделяется 6,28 г воды. Какова формула кристаллогидрата?
223. Если C  = 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (r = 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
= 2 моль/л, то какой объем этого раствора был взят для осаждения Al(OH)3 из раствора (r = 1,3 г/л) объемом 200 мл, в котором массовая доля AlCl3 составляет 30%? К полученному осадку до его полного растворения прибавлен раствор NaOH концентрации 0,5 моль/л. Найдите его объем.
224. Какой объем (н.у.) CO2 можно получить из 1246 г мрамора, в котором массовая доля CaCO3 составляет 89,6%? Какой объем соляной кислоты с массовой долей 20% для этого потребуется?
225. Раствор NaNO2, молярная концентрация эквивалента которого равна 0,1 экв/л, взят объемом 25 мл. Какой объем раствора KMnO4 той же концентрации потребуется для окисления нитрита в сернокислой среде?
226. Какой объем раствора нитрита натрия, молярная концентрация которого 0,15 моль/л, потребуется для реакции с 10 мл раствора KJ (r = 1,12 г/мл), в котором его массовая доля соли составляет 15%. В какой среде протекает эта реакция? Вычислите массу каждого из образующихся продуктов.
227. Какая масса PbO2 потребуется для окисления в присутствии серной кислоты нитрита натрия, находящегося в 200 мл раствора (r = 1,12 г/мл)?
228. Какой объем раствора KNO2 концентрации 1 моль/л потребуется для выделения в кислой среде всего йода из 20 мл раствора KJ (r = 1,12 г/мл), в котором массовая доля KJ составляет 15%?
229. Какой объем раствора NaOH концентрации 0,1 моль/л необходимо взять для нейтрализации Н3РО4, полученной из фосфата кальция массой 0,31 г?
230. Чему равен объем кислорода (н.у.), полученного из KClO3 и KMnO4, взятых массой по 1 кг?
231. Какой объем SO2 (н.у.) потребуется для полного обесцвечивания раствора KMnO4 объемом 250 мл, если его молярная концентрация эквивалента составляет 0,1 моль/л?
232. Найдите объем хлора, который выделится при взаимодействии K2Cr2O7 с раствором соляной кислоты объемом 250 мл, в котором массовая доля HСl составляет 30%, r = 1,48 г/см3).
233. Какой массы йод может быть получен при взаимодействии насыщенного раствора KJ: а) с хлором, объем которого равен 28 л (н.у.); б) с раствором объемом 50 мл, в котором массовая доля H2SO4 составляет 98%?
234. Найдите массу брома, который поглощается раствором гидроксида натрия объемом 300 мл, если С  = 2 моль/л.
= 2 моль/л.
235. Газ, выделившийся при взаимодействии NaCl массой 5,85 г с концентрированной серной кислотой, пропущен через раствор AgNO3 (r = 1,1 г/мл) объемом 200 мл, в котором массовая доля соли равна 10%. Найдите массы образовавшегося при этом осадка и AgNO3, оставшегося в растворе.
236. Какой объем (н.у.) хлора потребуется для взаимодействия с 10 мл горячего раствора Ba(OH)2, в котором массовая доля гидроксида составляет 3,75% (r = 1,04 г/мл).
237. Напишите уравнение реакции получения металлического хрома из окиси хрома алюминотермическим способом. Сколько металлического алюминия потребуется для получения 10 кг хрома?
238. Олово получают восстановлением оловянной руды SnO2 углем по схеме: SnO2 + С  Sn + CO2. Сколько тонн металлического олова можно получить из 10 т руды, содержащей 92% SnO2?
Sn + CO2. Сколько тонн металлического олова можно получить из 10 т руды, содержащей 92% SnO2?
239. Сколько аммиачной селитры получается при нейтрализации 50 г 40% HNO3 аммиаком?
240. Какой объем хлора вступил в реакцию с натрием, если выделилось 49,11 ккал тепла?
241. Сколько необходимо хлористого водорода и воды для получения 1 кг 33%-ной соляной кислоты?
242. Молярная концентрация эквивалента раствора K2Cr2O7 0,25 моль/л. Какой объем этого раствора надо взять для реакции с KJ в подкисленном серной кислотой растворе, содержащем йодид-ионы количеством вещества 0,01 моль?
243. Какой объем раствора с массовой долей HNO3 8% (r = 1,045 г/см) потребуется для растворения меди массой 24 г? Чему должен быть равен объем NO (н.у.), который при этом выделится?
244. Чем объяснить, что при большом различии в свойствах соединений марганца и хлора в низших валентных состояниях соединения этих же элементов в высших валентных состояниях имеют сходство? Сравнить Cl2O и MnO; Cl2O7 и Mn2O7.
245. Чем объяснить, что химическая активность d-металлов понижается по периоду и по группам Периодической системы, в результате наименее активные, благородные металлы (Pd, Pt, Au и т.д.) концентрируются в VIII и I группах V-VI периодов системы?
246. Сравнить кислотно-основной характер гидроксидов CuOH и Cu(OH)2. Какой из этих гидроксидов обладает амфотерными свойствами? Написать уравнения реакций, подтверждающих его амфотерный характер.
247. Какую массу хрома можно получить из 2,5 т хромистого железняка FeO  Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
Cr2O3, содержащего 15% посторонних веществ (пустой породы)?
248. На восстановление 0,05 л 0,2 Н K2Cr2O7 в присутствии разбавленной соляной кислоты затрачено 0,2 л раствора хлорида олова (II). Вычислите молярную концентрацию эквивалента раствора SnCl2.
249. Вычислите, какая масса дихромата калия потребовалась для приготовления 0,3 л 0,2 Н K2Cr2O7 (применительно к реакции окисления в кислой среде).
250. Кусок латуни массой 0,8 г растворен в азотной кислоте. При электролизе этого раствора на катоде выделилось 0,496 г меди. Напишите уравнения реакций и определите марку латуни, т.е. состав сплава (%).
Таблица 1
Стандартные электродные потенциалы
| ЭЛЕКТРОД | ЭЛЕКТРОДНАЯ РЕАКЦИЯ | φ0 в водных растворах при 250С |
| Li / Li+ | Li+ + e  Li0 Li0
| -3,045 |
| K / K+ | K+ + e  K0 K0
| -2,925 |
| Ba / Ba2+ | Ba2+ + 2e  Ba0 Ba0
| -2,90 |
| Sr / Sr2+ | Sr2+ + 2e  Sr0 Sr0
| -2,89 |
| Ca / Ca2+ | Ca2+ + 2e  Ca0 Ca0
| -2,87 |
| Na / Na+ | Na+ + e  Na0 Na0
| -2,714 |
| Mg / Mg2+ | Mg2+ + 2e  Mg0 Mg0
| -2,07 |
| Ti / Ti2+ | Ti2+ + 2e  Ti0 Ti0
| -1,75 |
| Be / Be2+ | Be2+ + 2e  Be0 Be0
| -1,70 |
| Al / Al3+ | Al3+ + 3e  Al0 Al0
| -1,66 |
| V / V2+ | V2+ + 2e  V0 V0
| -1,50 |
| Mn / Mn2+ | Mn2+ + 2e  Mn0 Mn0
| -1,18 |
SO  , SO , SO  (Pt) (Pt)
| SO  +2e + H2O +2e + H2O  SO SO  + 2OH- + 2OH-
| -0,90 |
| Cr / Cr2+ | Cr2+ + 2e  Cr0 Cr0
| -0,86 |
NO2(г), NO 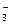 (Pt) (Pt)
| NO 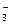 + e + H2O + e + H2O  NO2(г) + 2OH- NO2(г) + 2OH-
| -0,85 |
| Н2, Н2О (Pt) | 2Н2О + 2e  Н2 + 2ОН– Н2 + 2ОН–
| -0,83 |
| Zn / Zn2+ | Zn2+ + 2e  Zn0 Zn0
| -0,763 |
| Cr / Cr3+ | Cr3+ + 3e  Cr0 Cr0
| -0,74 |
S2O  , SO , SO  (Pt) (Pt)
| 2 SO  +4e + 3H2O +4e + 3H2O  S2O S2O  +6OH- +6OH-
| -0,58 |
| Pb, PbO, OH- | PbO + 2e + H2O  Pb0 + 2OH- Pb0 + 2OH-
| -0,578 |
| Fe(OH)2, Fe(OH)3 (Pt) | Fe(OH)3 + e  Fe(OH)2 + OH- Fe(OH)2 + OH-
| -0,56 |
| S / S2- | S + 2e  S2- S2-
| -0,48 |
| Fe / Fe2+ | Fe2+ + 2e  Fe0 Fe0
| -0,44 |
| Cd / Cd2+ | Cd2+ + 2e  Cd0 Cd0
| -0,402 |
Pb, PbSO4, SO 
| PbSO4 + 2e  Pb0 + SO Pb0 + SO 
| -0,356 |
| Co / Co2+ | Co2+ + 2e  Co0 Co0
| -0,27 |
| Ni / Ni2+ | Ni2+ + 2e  Ni0 Ni0
| -0,25 |
| Ag, AgI, I- | AgI + e  Ag0 + I- Ag0 + I-
| -0,152 |
| Ge, GeO2, H+ | GeO2 + 4e + 4H+  Ge0 + 2H2O Ge0 + 2H2O
| -0,15 |
| Sn / Sn2+ | Sn2+ + 2e  Sn0 Sn0
| -0,14 |
| Pb / Pb2+ | Pb2+ + 2e  Pb0 Pb0
| -0,126 |
Продолжение таблицы 1
| Hg, Hg2I2, I- | ½ Hg2I2 + e  Hg0 + I- Hg0 + I-
| -0,040 |
| Fe, Fe3+ | Fe3+ + 3e  Fe0 Fe0
| -0,036 |
| Н2, Н+ (Pt) | Н+ + e  1/2Н2 1/2Н2
| 0,000 |
NO  , NO , NO 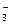 (Pt) (Pt)
| NO 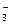 + 2e + H2O + 2e + H2O  NO NO  + 2OH- + 2OH-
| 0,01 |
| Ag, AgBr, Br- | 2AgBr + 2e  2Ag0 + 2Br- 2Ag0 + 2Br-
| 0,071 |
| Hg, Hg2Br2, Br- | ½ Hg2Br2 + e  Hg0 + Br- Hg0 + Br-
| 0,140 |
| Sn2+, Sn4+ (Pt) | Sn4+ + 2e  Sn2+ Sn2+
| 0,150 |
| Cu+, Cu2+ (Pt) | Cu2+ + e  Cu+ Cu+
| 0,153 |
| Bi, Bi3+ | Bi3+ + 3e  Bi0 Bi0
| 0,21 |
| Ag, AgCl, Cl- | AgCl + e  Ag0 + Cl- Ag0 + Cl-
| 0,222 |
| Hg, Hg2Cl2, Cl- | ½ Hg2Cl2 + e  Hg0 + Cl- Hg0 + Cl-
| 0,268 |
| Cu / Cu2+ | Cu2+ + 2e  Cu0 Cu0
| 0,34 |
| [Fe(CN)6]4-, [Fe(CN)6]3- (Pt) | [Fe(CN)6]3- + e  [Fe(CN)6]2- [Fe(CN)6]2-
| 0,36 |
| О2, ОН– | Н2О + 2e + 1/2О2  2ОН– 2ОН–
| 0,401 |
| Co / Co3+ | Co3+ + 3e  Co0 Co0
| 0,43 |
| Cu / Cu+ | Cu+ + e  Cu0 Cu0
| 0,52 |
| I2(тв), I- | ½ I2 + e  I- I-
| 0,536 |
MnO  , MnO , MnO  (Pt) (Pt)
| MnO  + e + e  MnO MnO 
| 0,54 |
MnO2, MnO 
| MnO  + 2e + H2O + 2e + H2O  MnO2 + 4OH- MnO2 + 4OH-
| 0,58 |
Hg, Hg2SO4, SO 
| Hg2SO4 + 2e  2Hg0 + SO 2Hg0 + SO 
| 0,615 |
| Hg2Cl2, HgCl2 | 2HgCl2 + 2e  Hg2Cl2 + 2Cl- Hg2Cl2 + 2Cl-
| 0,62 |
U4+, UO  , H+ (Pt) , H+ (Pt)
| UO  + e + 4H+ + e + 4H+  U4+ + 2H2O U4+ + 2H2O
| 0,62 |
| Pb, PbO2, H+ | PbO2 + 4e + 4H+  Pb0 + 2H2O Pb0 + 2H2O
| 0,67 |
| H2O2, O2, H+ | O2 + 2e + 2H+  H2O2 H2O2
| 0,68 |
| Хинон, гидрохинон, Н+ (Pt) | C6H4O2 + 2e + H+  C6H4(OH)2 C6H4(OH)2
| 0,699 |
| Fe2+, Fe3+ (Pt) | Fe3+ + e  Fe2+ Fe2+
| 0,771 |
Hg / Hg 
| Hg  + 2e + 2e  2Hg0 2Hg0
| 0,798 |
| Ag / Ag+ | Ag+ + e  Ag0 Ag0
| 0,799 |
| Hg / Hg2+ | Hg2+ + 2e  Hg0 Hg0
| 0,86 |
Hg  , Hg2+ (Pt) , Hg2+ (Pt)
| 2Hg2+ + 2e  Hg Hg 
| 0,94 |
| Br, Br- | ½ Br2 + 2e  Br- Br-
| 1,066 |
| О2, Н2О, Н+ (Pt) | 4Н+ + О2 + 4e  2Н2О 2Н2О
| 1,23 (1,5)* |
| Mn2+, MnO2 | MnO2 + 2e + 4H+  Mn2+ + 2H2O Mn2+ + 2H2O
| 1,28 |
| Cl2, Cl- (Pt) | ½ Cl2 + e  Cl- Cl-
| 1,36 |
Продолжение таблицы 1
| Au / Au3+ | Au3+ + 3e  Au0 Au0
| 1,42 |
| PbO2, Pb2+, H+ (Pt) | PbO2 + 2e + 4H+  Pb2+ + 2H2O Pb2+ + 2H2O
| 1,456 |
Mn2+, MnO  , H+ (Pt) , H+ (Pt)
| MnO  + 5e + 8H+ + 5e + 8H+  Mn2+ + 4H2O Mn2+ + 4H2O
| 1,52 |
PbO2, PbSO4, SO 
| PbO2 + 2e+4H++ SO   PbSO4 + 2H2O PbSO4 + 2H2O
| 1,685 |
| H2O, H2O2, H+ | H2O2 + 2e + 2H+  2H2O 2H2O
| 1,77 |
| Co2+, Co3+ (Pt) | Co3+ + e  Co2+ Co2+
| 1,84 |
SO  , S2O , S2O 
| S2O  + 2e + 2e  2 SO 2 SO 
| 2,05 |
| O2, O3 | O3 + e + 4H+  O2 + 2H2O O2 + 2H2O
| 2,85 |
| F2, F- | ½ F2 + e  F- F-
| 2,85 |
* – с учетом перенапряжения
Библиографический список
1. Глинка, Н.Л. Общая химия / Н.Р. Глинка. – М.: Интеграл – Пресс, 2002.-727 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. – М.: Интеграл – Пресс, 2001.-240 с.
3. Коровин, Н.В. Общая химия / Н.В. Коровин. – М.: Высш. шк., 2000. – 558 с.
4. Угай, Я.А. Общая и неорганическая химия / Я.А. Угай. – М.: Высш. шк., 2002. – 527 с.
5. Фримантл, М. Химия в действии: в 2-х ч. Ч.1 / М. Фримантл. – М.: Мир, 1998. – 528 с.
6. Фримантл, М. Химия в действии: в 2-х ч. Ч.2 / М. Фримантл. – М.: Мир, 1998. – 511 с.
ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
| вар | Номера задач | ||||||||||
| вар | Номера задач | ||||||||||
| вар | Номера задач | ||||||||||
Дата добавления: 2015-04-16; просмотров: 412; Мы поможем в написании вашей работы!; Нарушение авторских прав |