
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гальванические элементы
Устройства, в которых энергия химической окислительно–восстановительной реакции превращается в электрическую энергию, называются химическими источниками электрической энергии, или гальваническими элементами.
Гальванический элемент состоит из двух электродов, сообщающихся друг с другом. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой элемента (ЭДС).
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов (Е), каждый из которых отвечает полуреакции, протекающей на одном из электродов:
ЭДС=φК –φА
Пример 1
Гальванические элементы составлены по схеме:
а) Fe3+,Fe2+ II Ag+,Ag
Рассчитать ЭДС этих элементов при стандартных условиях и найдите изменение энергии Гиббса, протекающих в реакциях, уравнения которых напишите в ионно-молекулярной и молекулярной форме.
Решение:
а) (–)(Pt)Fe3+,Fe2+//Ag+,Ag(+)
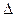 Е (ЭДС) = φ(окислит.) – φ(восстановит.)
Е (ЭДС) = φ(окислит.) – φ(восстановит.)
φ(Fe3+/Fe2+) = 0,77 В (восстановитель находим по таблице)
φ(Ag+/Ag) = 0,80 В (окислитель находим по таблице)
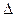 Е= 0,80 В – 0,77 В = 0,03 В
Е= 0,80 В – 0,77 В = 0,03 В
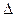 G (Энергия Гиббса) = –n F
G (Энергия Гиббса) = –n F 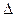 Е
Е
n – число электронов, участвующих в процессе
F – число Фарадея
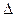 Е – ЭДС
Е – ЭДС
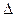 G = –1
G = –1  96485
96485  0,03 В = – 2894,55 Дж = –2,8 кДж
0,03 В = – 2894,55 Дж = –2,8 кДж
Уравнения реакций:
Ag+ + 1e  Ag окислитель Ag окислитель
| |
Fe2+– 1e  Fe3+ восстановитель Fe3+ восстановитель
|
Ag+ + Fe2+  Ag+ Fe3+
Ag+ Fe3+
2AgNO3+Fe(NO3)3  2Ag + Fe(NO3)3
2Ag + Fe(NO3)3
(серебряный и железный электрод опущены в раствор нитратов, которые разделены пористой перегородкой).
Пример 2
Составить схему гальванического элемента, в котором протекает реакция:
Pb + SO  + Sn4+
+ Sn4+  PbSO4 + Sn2+
PbSO4 + Sn2+
Решение:Из справочной таблицы выписываем полуреакции с электродными потенциалами:
Pb + SO  –2e–
–2e–  PbSO4 ; φ0=–0,356 В
PbSO4 ; φ0=–0,356 В
Sn4+ + 2e–  Sn2+ ; φ0=0,15 В
Sn2+ ; φ0=0,15 В
Значит, на аноде протекает первый процесс, а на катоде – второй.
Схема гальванического элемента:
 |
(+)Pb, PbSO4, SO  // Sn4+,Sn2+(Pt)(–)
// Sn4+,Sn2+(Pt)(–)
Задачи
Составьте схему электродных процессов, суммарную реакцию и гальванический элемент, в котором возможно протекание указанной реакции. Рассчитайте значение стандартной электродвижущей силы.
136. Zn + 4OH– + Sn2+ = ZnO  + 2H2O + Sn
+ 2H2O + Sn
137. Pb + SO  + Sn2+ = PbSO4 + Sn
+ Sn2+ = PbSO4 + Sn
138. 3H2 + Н2SO4 = 4H2O + S0
139. PbSO4 + Ba = Pb + SO  + Ba2+
+ Ba2+
140. Pb + SO  + Ni2+ = PbSO4 + Ni0
+ Ni2+ = PbSO4 + Ni0
141. 2Ag + 2Cl– + J2 = 2AgCl + 2J–
142. Cu + J2 = Cu2+ + 2J–
143. 2AuCl3 = 2Au + 3Cl2
144. 2J– + Br2 = 2Br– + J2
145. Mn2+ + Cl2 + 2H2O = MnO2 + 4H+ + 2Cl–
146. MnO2 + 4OH– + 3Ag+ = MnO  + 2H2O + 3Ag0
+ 2H2O + 3Ag0
147. PbO2 + 4H+ + 2Hg + 2J– = Pb2+ + 2H2O + Hg2J2
148. Sn2+ + NO  + 2OH– = Sn0 + NO
+ 2OH– = Sn0 + NO  + H2O
+ H2O
149. 2Cr2O  + 16H+ = 3O2 + 4Cr3+ + 8H2O
+ 16H+ = 3O2 + 4Cr3+ + 8H2O
150. Fe3+ + MnO  = Fe2+ + MnO
= Fe2+ + MnO 
151. MnO2 + 2NO + 2H+ = 2Mn2+ + 2HNO3
152. H2 + 2OH– + 2Ni2+ = Ni + 2H2O
153. H2O2 + Hg2+ = O2 + 2H+ + Hg
154. 2Cl– + PbO2 + 4H+ = Cl2 + Pb2+ + 2H2O
155. PbSO4 + 2H2O + 2Cu2+ = 2Cu+ + PbO2 +4H+ + SO 
156. PbO2 + 4H+ + 2Hg + 2J– = Pb2+ + 2H2O + Hg2J2
157. 2Ag + 2Br– + Hg2Cl2 = 2AgBr + 2Hg + 2Cl–
158. Hg + PbO = HgO + Pb
159. Ag+ + Cl– = AgCl
160. 2Cr2+ + PbO2 + 4H+ = 2Cr3+ + 2Pb2+ + 2H2O
Дата добавления: 2015-04-16; просмотров: 791; Мы поможем в написании вашей работы!; Нарушение авторских прав |