
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Термодинамиканың екінші бастамасы
Алдымен тура бағытта, сосын кері бағытта орындалатын процесте ТД жүйе және онымен әсерлесетін барлық сыртқы денелер алғашқы күйіне қайта оралатын процесті қайтымды деп атайды.
Энтропия. Газ молекулалардың жылулық қозғалысының ерекшелігі - оның ретсіздігінде. Изотермдік процесте жүйенің алған жылуының энергия көзінің температурасына қатынасы келтірілген  жылу мөлшері деп аталады:
жылу мөлшері деп аталады:  Процестің шексіз аз бөлігінде келтірілген
Процестің шексіз аз бөлігінде келтірілген  жылу мөлшері
жылу мөлшері 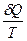 -ге тең, ал нақты екі бөлігінің арасында (
-ге тең, ал нақты екі бөлігінің арасында ( 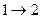 ):
): 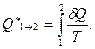
Кез келген қайтымды циклде:  Толық дифференциалы процестің шексіз аз бөлігінде келтірілген жылу мөлшеріне тең күй функциясын энтропия( S ) деп атайды:
Толық дифференциалы процестің шексіз аз бөлігінде келтірілген жылу мөлшеріне тең күй функциясын энтропия( S ) деп атайды:
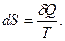 (80)
(80)
Оқшауланған тұйық жүйедегі қайтымсыз процесте жүйенің энтропиясы әрқашан артады: 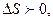 ал қайтымды процесте өзгермейді:
ал қайтымды процесте өзгермейді: 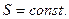 Осы екі жағдай Клаузиус теңсіздігіне біріктірілген:
Осы екі жағдай Клаузиус теңсіздігіне біріктірілген:
 (81)
(81)
ТД жүйе бір күйден екінші күйге ( 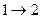 ) өткенде энтропияның өзгерісі осы күйлерге сәйкес энтропиялардың айырымына тең:
) өткенде энтропияның өзгерісі осы күйлерге сәйкес энтропиялардың айырымына тең:
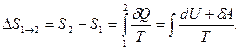 (82)
(82)
Адиабаттық қайтымды процесте ( 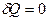 ) энтропия тұрақты
) энтропия тұрақты 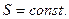 Сондықтан оны изоэнтропиялық процесс деп те атайды.
Сондықтан оны изоэнтропиялық процесс деп те атайды.
Изотермдік процестегі (  ) энтропияның өзгерісі:
) энтропияның өзгерісі: 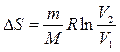 .
.
Изохорлық процестегі ( 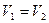 ) энтропияның өзгерісі:
) энтропияның өзгерісі: 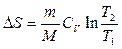 .
.
Энтропия - аддитивті шама: термодинамикалық жүйенің энтропиясы жүйенің құрамдас бөліктерінің (жүйеге кіретін денелердің) энтропияларының қосындысына тең.
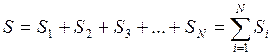 . (83)
. (83)
Макрожүйенің қандай да бір нақты күйге келу әдістерінің саны жүйе күйінің термодинамикалық ықтималдығы деп аталады. Жүйенің энтропиясы мен термодинамикалық ықтималдық арасындағы байланыс Больцман формуласымен анықталады:
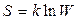 (84)
(84)
Жүйе күйінің термодинамикалық ықтималдығы W жүйені құрайтын бөлшектердің координаттар және жылдамдықтар бойынша таралу санына тең ( 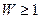 ). Оңашаланған тұйық жүйедегі қайтымды процестерде термо-динамикалық ықтималдық тұрақты болады (
). Оңашаланған тұйық жүйедегі қайтымды процестерде термо-динамикалық ықтималдық тұрақты болады ( 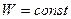 ), ал қайтымсыз процестерде ылғи артып отырады (
), ал қайтымсыз процестерде ылғи артып отырады ( 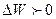 ). Осыдан шығатын қорытынды: қайтымсыз процестің нәтижесінде жүйе ең төменгі орнықсыз ықтимал күйден ең жоғарғы орнықты күйге (тепе-теңдікке) келеді.
). Осыдан шығатын қорытынды: қайтымсыз процестің нәтижесінде жүйе ең төменгі орнықсыз ықтимал күйден ең жоғарғы орнықты күйге (тепе-теңдікке) келеді.
Больцман формуласы МКТ-ның негізінде энтропияның статистикалық мағынасын айқындайды: энтропияның анықтамасына сәйкес жүйе күйінің шексіз аз қайтымды өзгерісінде оған берілген жылу мөлшері 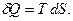 Сонда термодинамиканың бірінші бастамасы бойынша қайтымды процесте термодинамикалық тепе-теңдік орындалады:
Сонда термодинамиканың бірінші бастамасы бойынша қайтымды процесте термодинамикалық тепе-теңдік орындалады:
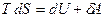 .
.
Термодинамиканың екінші бастамасы жүйеде өтіп жатқан процестің бағытын анықтауға мүмкіндік береді. Клаузиус теңсіздігі мен энтропия ұғымы екінші бастаманы қайтымсыз процестер үшін тұйық жүйе энтропиясының арту заңы түрінде тұжырымдайды.
Екінші бастаманың басқа қорытындылары:
1) Кельвин бойынша: нәтижесінде қыздырғыштан алынған жылу мөлшерін толығымен пара-пар жұмысқа айналдыратын циклдік процесті жүзеге асыруға болмайды;
2) Клаузиус бойынша: нәтижесінде температурасы төмен салқын денеден температурасы жоғары қызған денеге жылу берілетін циклдік процесті жүзеге асыруға болмайды;
ТД-ның алғашқы екі бастамасы температурасы абсолют нөлге жақын жүйенің күйі туралы айқын сипаттама бермейді. Бұл жағдай термоди-намиканың үшінші бастамасыментолықтырылған (Нернст-Планк теоремасы): тепе-тең күйдегі барлық денелердің энтропиясы жүйенің температурасы абсолют нөлге жақындағанда нөлге ұмтылады.
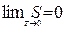 (85)
(85)
Дата добавления: 2014-10-31; просмотров: 1460; Мы поможем в написании вашей работы!; Нарушение авторских прав |