
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплоемкость газов
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1°С
За единицу количества энергии в системе СИ применяют джоуль (Дж). В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж =Н·м=1 кг·м2/с2).
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость µc – кДж/(кмоль·К), массовую теплоемкость c – кДж/(кг·К) и объемную теплоемкость c’– кДж/(м3·К).
Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
 , (4.1)
, (4.1)
а объемная теплоемкость
 . (4.2)
. (4.2)
Объемная и массовая теплоемкости связаны между собой зависимостью

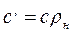
где ρн - плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
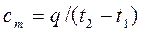 , (4.3)
, (4.3)
Сm – представляет собой среднюю теплоемкость в пределах (t2-t1). Предел этого отношения, когда разность температур стремится к нулю, называется истинной теплоемкостью
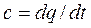
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную – в процессах при постоянном объеме (  и
и  ) и постоянном давлении (
) и постоянном давлении (  и
и  );
);
б) массовую – в процессах при постоянном объеме (  и
и 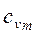 ) и постоянном давлении (
) и постоянном давлении (  и
и  );
);
в) объемную – в процессах при постоянном объеме ( 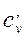 и
и  ) и постоянном давлении (
) и постоянном давлении (  и
и  );
);
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость:
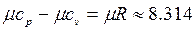
 (4.4)
(4.4)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 4.1).
Таблица 4.1.
Приближенные значения мольных теплоемкостей
| Газы | Теплоемкость в кДж/(кмоль·К) | |
 v v
|  p p
| |
| Одноатомные | 12,56 | 20,93 |
| Двухатомные | 20,93 | 29,31 |
| Трех- и многоатомные | 29,31 | 37,68 |
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k:
Для одноатомных газов k =1,67; для двухатомных газов k =1,4; для трех- и многоатомных газов k =1,29.
Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1до t2,
 , (4.5)
, (4.5)
где  и
и  - средние теплоемкости в пределах 0°-
- средние теплоемкости в пределах 0°-  и 0°-
и 0°-  .
.
Для определения количества теплоты, затрачиваемой в процессах при постоянном давлении и постоянном объеме использовать формулы (4.6), (4.7)
 (4.6)
(4.6)
 (4.7)
(4.7)
Если в процессе участвуют  кг и
кг и  м3 газа, то:
м3 газа, то:
 (4.8)
(4.8)  ; (4.9)
; (4.9)
Нелинейную зависимость истинной теплоемкости от температуры представляют обычно уравнением вида:
 ,
,
где а, b и d – величины постоянные для данного газа.
При замене нелинейной зависимости линейной, истинная теплоемкость примет вид:
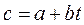 ,
,
а средняя теплоемкость в пределах 0° - 
 (4.10)
(4.10)
В табл. 4.2 приведены интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а в табл. 4.3 - для средних массовых объемных теплоемкостей при постоянном объеме.
Теплоемкость газовой смеси:
массовая: 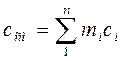 (4.11)
(4.11)
объемная: 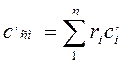 (4.12)
(4.12)
мольная:  (4.13)
(4.13)
Таблица 4.2.
Интерполяционные формулы для истинных и средних мольных теплоемкостей газов
| Газ | Мольная теплоемкость при  в кДж/(кмоль·К) в кДж/(кмоль·К)
| |
| Истинная | средняя | |
| В пределах 0 - 1000°С | ||
| О2 | 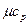 =29,5802 + 0,0069706 t =29,5802 + 0,0069706 t
|  =29,2080 + 0,0040717 t =29,2080 + 0,0040717 t
|
| N2 | 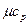 =28,5372 + 0,0053905 t =28,5372 + 0,0053905 t
|  =28,7340 + 0,0023488 t =28,7340 + 0,0023488 t
|
| СО | 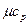 =28,7395 + 0,0058862 t =28,7395 + 0,0058862 t
|  =28,8563 + 0,0026808 t =28,8563 + 0,0026808 t
|
| Воздух | 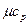 =28,7558 + 0,0057208 t =28,7558 + 0,0057208 t
|  =28,8270 + 0,0027080 t =28,8270 + 0,0027080 t
|
| Н2О | 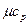 =32,8367 + 0,0116611 t =32,8367 + 0,0116611 t
|  =33,1494 + 0,0052749 t =33,1494 + 0,0052749 t
|
| SО2 | 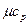 =42,8728 + 0,0132043 t =42,8728 + 0,0132043 t
|  =40,4386 + 0,0099562 t =40,4386 + 0,0099562 t
|
| В пределах 0 - 1500°С | ||
| H2 | 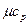 =28,3446 + 0,0031518 t =28,3446 + 0,0031518 t
|  =28,7210 + 0,0012008 t =28,7210 + 0,0012008 t
|
| CO2 | 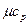 =41,3597 + 0,0144985 t =41,3597 + 0,0144985 t
|  =38,3955 + 0,0105838 t =38,3955 + 0,0105838 t
|
| В пределах 1000 - 2700°С | ||
| O2 | 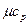 =33,8603 + 0,0021951 t =33,8603 + 0,0021951 t
|  =31,5731 + 0,0017572 t =31,5731 + 0,0017572 t
|
| N2 | 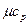 =32,7466 + 0,0016517 t =32,7466 + 0,0016517 t
|  =29,7815 + 0,0016835 t =29,7815 + 0,0016835 t
|
| CO | 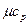 =33,6991 + 0,0013406 t =33,6991 + 0,0013406 t
|  =30,4242 + 0,0015579 t =30,4242 + 0,0015579 t
|
| Воздух | 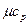 =32,9564 + 0,0017806 t =32,9564 + 0,0017806 t
|  =30,1533 + 0,0016973 t =30,1533 + 0,0016973 t
|
| H2О | 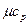 =40,2393 + 0,0059854 t =40,2393 + 0,0059854 t
|  =34,5118 + 0,0045979 t =34,5118 + 0,0045979 t
|
| В пределах 1500 - 3000°С | ||
| H2 | 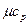 =31,0079 + 0,0020243 t =31,0079 + 0,0020243 t
|  =31,5731 + 0,0017572 t =31,5731 + 0,0017572 t
|
| СО2 | 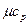 =56,8768 + 0,0021738 t =56,8768 + 0,0021738 t
|  =48,4534 + 0,0030032 t =48,4534 + 0,0030032 t
|
Таблица 4.3.
Интерполяционные формулы
для средних массовых и объемных теплоемкостей газов
| Газ | Теплоемкость в кДж/(кг·К) | |
| Массовая | объемная | |
| В пределах 0 - 1000°С | ||
| О2 |  = 0,9127 + 0,00012724 t = 0,9127 + 0,00012724 t
|  = 1,3046 + 0,00018183 t = 1,3046 + 0,00018183 t
|
 = 0,6527 + 0,00012724 t = 0,6527 + 0,00012724 t
| 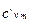 = 0,9337 + 0,00018183 t = 0,9337 + 0,00018183 t
| |
| N2 |  = 1,0258 + 0,00008382 t = 1,0258 + 0,00008382 t
|  = 1,2833 + 0,00010492 t = 1,2833 + 0,00010492 t
|
 = 0,7289 + 0,00008382 t = 0,7289 + 0,00008382 t
| 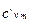 = 0,9123 + 0,00010492 t = 0,9123 + 0,00010492 t
| |
| СО |  = 1,0304 + 0,00009575 t = 1,0304 + 0,00009575 t
|  = 1,2883 + 0,00011966 t = 1,2883 + 0,00011966 t
|
 = 0,7335 + 0,00009575 t = 0,7335 + 0,00009575 t
| 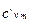 = 0,9173 + 0,00011966 t = 0,9173 + 0,00011966 t
| |
| Воздух |  = 0,9952 + 0,00009349 t = 0,9952 + 0,00009349 t
|  = 1,2870 + 0,00012191 t = 1,2870 + 0,00012191 t
|
 = 0,7084 + 0,00009349 t = 0,7084 + 0,00009349 t
| 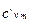 = 0,9161 + 0,00012191 t = 0,9161 + 0,00012191 t
| |
| Н2О |  = 1,8401 + 0,00029278 t = 1,8401 + 0,00029278 t
|  = 1,4800 + 0,00023551 t = 1,4800 + 0,00023551 t
|
 = 1,3783 + 0,00029278 t = 1,3783 + 0,00029278 t
| 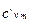 = 1,1091 + 0,00023551 t = 1,1091 + 0,00023551 t
| |
| SО2 |  = 0,6314 + 0,00015541 t = 0,6314 + 0,00015541 t
|  = 1,8472 + 0,00004547 t = 1,8472 + 0,00004547 t
|
 = 0,5016 + 0,00015541 t = 0,5016 + 0,00015541 t
| 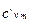 = 1,4763 + 0,00004547 t = 1,4763 + 0,00004547 t
| |
| В пределах 0 - 1500°С | ||
| H2 |  = 1,42494 + 0,00059574 t = 1,42494 + 0,00059574 t
|  = 1,2803 + 0,00005355 t = 1,2803 + 0,00005355 t
|
 = 1,01241 + 0,00059574 t = 1,01241 + 0,00059574 t
| 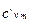 = 0,9094 + 0,00005355 t = 0,9094 + 0,00005355 t
| |
| CO2 |  = 0,8725 + 0,00024053 t = 0,8725 + 0,00024053 t
|  = 1,7250 + 0,00004756 t = 1,7250 + 0,00004756 t
|
 = 0,6837 + 0,00024053 t = 0,6837 + 0,00024053 t
| 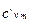 = 1,3540 + 0,00004756 t = 1,3540 + 0,00004756 t
|
Задачи
4.1. Найти объемную теплоемкость кислорода при постоянном объеме и постоянном давлении, считая с=const.
Решение:
По табл. 4.1 для двухатомных газов: mCv=20.93 кДж/(кмоль К);
mCp=29.31 кДж/(кмоль К);
Cледовательно, для кислорода (и любого двухатомного газа)
Сv=mCv/22.4=20.93/22.4=0.934 кДж/( м3 К);
Cp=mCp/22.4=29.31/22.4=1.308 кДж/(м3 К).
Ответ: Ср=1.308 кДж/( м3 К); Сv=0.934 кДж/( м3 К).
4.2. Определить значение массовой теплоемкости кислорода при постоянном объеме и постоянном давлении, считая с=const.
Ответ: Ср=0.916 кДж/(кг К); Сv=0.654 кДж/(кг К).
4.3. Вычислить среднюю массовую и среднюю объемную теплоемкость окиси углерода при постоянном объеме для интервала температур 0-1200 0С, если известно, что для окиси углерода (mСpm)01200=32.192 кДж/(кмоль К).
Решение:
На основании формул (4.1),(4.2) и (4.3) имеем
(mСv)01200=32.192-8.314=23.877 кДж/(кмоль К);
(Сvm)01200=(mCv)01200/28=23.877/28=0.8528 кДж/(кг К);
(Cvm)01200=(mCv)01200/22.4=23.877/22.4=1.0659 кДж/(м3 К).
Ответ: (mСv)01200=23.877 кДж/(кмоль К); (Сvm)01200 =0.8528 кДж/(кг К);
(Cvm)01200 =1.0659 кДж/(м3 К).
4.4.Вычислить среднюю теплоемкость Сpm для воздуха при постоянном давлении в пределах 200-800 0С, считая зависимость теплоемкости от температуры нелинейной.
Ответ: (Сpm)200800=1.091 кДж/(кг К).
4.5.Вычислить среднюю теплоемкость Сpm и Сvm в пределах 200-800 0С для СО, считая зависимость теплоемкости от температуры линейной.
Ответ: Сpm=1.1262 кДж/(кг К); Сvm=1.0371 кДж/(м3 К).
4.6. Найти среднюю теплоемкость Сpm и Cvm для воздуха в пределах 400-1200 0С, считая зависимость теплоемкости от температуры нелинейной.
Ответ: Сpm =1.4846 кДж/(м3 К);Cvm =1.1137кДж/(м3 К).
4.7. В закрытом сосуде объемом V=300 л находится воздух при давлении р1=0.8 МПа и температуре t1=20 0С. Какое количество теплоты необходимо подвести для того, чтобы температура воздуха поднялась до t2=120 0С? Задачу решить, принимая теплоемкость воздуха постоянной, а также учитывая зависимость теплоемкости от температуры. Определить относительную ошибку, получаемую в первом случае.
Ответ: Q=77.3 кДж. Относительная ошибка e»0.25 %.
4.8. Воздух охлаждается от 1000 0С до 100 0С в процессе с постоянным давлением. Какое количество теплоты теряет 1 кг воздуха? Задачу решить, принимая теплоемкость воздуха постоянной, а также учитывая зависимость теплоемкости от температуры. Определить относительную ошибку, получаемую в первом случае.
Ответ: 1). qcp=const =-911.9 кДж/кг;
2). qcp=f(t)=-990.1 кДж/кг; e»8%.
4.9. В сосуде объемом 300 л находится кислород при давлении р1=0.2 МПа и температуре t1=20 0С. Какое количество теплоты необходимо подвести, чтобы температура кислорода повысилась до t2=300 0С? Какое давление установится при этом в сосуде? Зависимость теплоемкости от температуры принять нелинейной.
Ответ: Qv= 152.8 кДж; Р2=0.39 МПа
4.10. Газовая смесь имеет следующий состав по объему: СО2=0.12; O2=0.07; N2=0.75; H2O=0.06.Определить среднюю массовую теплоемкость Сpm, если смесь нагревается от 100 0С до 300 0С.
Ответ: Сpm=1.0928 кДж/(кг К)
Дата добавления: 2014-11-13; просмотров: 2962; Мы поможем в написании вашей работы!; Нарушение авторских прав |