
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Газовые смеси
Состав газовой смеси определяется количеством каждого из газов, входящих в смесь, и может быть задан массовыми или объемными долями.
Массовая доля определяется отношением массы отдельного газа, входящего в смесь, к массе всей смеси:
m1=M1/M, m2=M2/M, mN=MN/M,
где M1, M2, M3, MN – массы отдельных газов и M – масса всей смеси.
Объемной долей газа называют отношение объема каждого компонента, входящего в смесь, к объему всей газовой смеси при условии, что объем каждого компонента отнесен к давлению и температуре смеси (приведенный объем):
r1=V1/V, r2=V2/V, rN=VN/V,
где V1, V2, VN – приведенные объемы компонентов газов, входящих в смесь;
V – общий объем газовой смеси.
Очевидно, что
M1+M2+M3+…..+MN=М;
m1+m2+m3+…..+mN=1,
а также
V1+V2+V3+…..+VN=V;
r1+r2+r3+…..+rN=1.
Для перевода массовых долей в объемные пользуются формулой:
 (3.1)
(3.1)
Объемные доли переводят в массовые по формуле:
 (3.2)
(3.2)
Плотность смеси определяют из выражения:
 ,
,  (3.3)
(3.3)
или, если известен массовый состав, по формуле:
 ,
,  (3.4)
(3.4)
Удельный объем смеси представляет величину, обратную ρсм; поэтому, если дан объемный состав смеси, то:
 ,
,  (3.5)
(3.5)
Если же известен массовый состав, то:
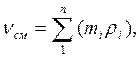
 (3.6)
(3.6)
Из уравнения (26) легко получить значение так называемой кажущейся молекулярной массы газовой смеси:
 (3.7)
(3.7)
или через массовый состав:
 (3.8)
(3.8)
Газовую постоянную смеси газов (Rсм) можно выразить или через газовые постоянные отдельных компонентов, входящих в смесь, или через кажущуюся молекулярную массу смеси:

 (3.9)
(3.9)
или

 (3.10)
(3.10)
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов:
Р =р1+р2+р3+ …. +рN, (3.11)
где Р – общее давление газовой смеси;
р1, р2, р3, рN – парциальное давление отдельных компонентов, входящих в смесь.
Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь;
р1=рr1, р2=рr2 и т.д.
или вообще
рi=рri, (3.12)
где рi – парциальное давление любого газа, входящего в смесь:
рi=mi(Ri/Rсм)р.
Задачи
3.1. Атмосферный воздух имеет примерно следующий массовый состав:
mO2=23.2%; mN2=76.8%. Определить объемный состав воздуха , его газовую постоянную , кажущуюся молекулярную массу и парциальные давления кислорода и азота, если давление воздуха по барометру В=101 325 Па.
Решение:
По уравнению (3.1) получаем
rO2=(mO2/mO2)/(mO2/mO2+mN2/mN2)=(23.2/32)/(23.2/32+76.8/28.02)=0.2;
rN2=(mN2/mN2)/(mO2/mO2+mN2/mN2)=(76.8/28.02)/(23.2/32+76.8/28.02) =0.79.
Газовую постоянную воздуха находим по уравнению (3.9):
Rсм=Sm i R i=mO2RO2+mN2RN2=0.232·260+0.768·295=287 Дж/кг К.
Кажущуюся молекулярную массу смеси определяем из уравнения (3.7)
mсм=Sr i m i=rO2mO2+rN2mN2=0.21·32+0.79·28.02=28.9
или из уравнения (3.10)
Rсм=8314/mcм.
Отсюда
mcм=8314/Rсм=8314/287=28.9
Парциальные давления получим из уравнения (3.12) р i =r i p,
следовательно,
рО2= rO2 Р=0.21∙101 325=21 278 Па; рN2=rN2p=0.79∙101 325=80 047 Па.
Ответ: rO2=0.2; rN2=0.79; Rсм=287Дж/кгК;mcм=28.9; рО2=21 278 Па; рN2=80 047 Па
3.2. В 1 м3 сухого воздуха содержится примерно 0.21 м3 кислорода и 0.79 м3 азота. Определить массовый состав воздуха, его газовую постоянную и парциальные давления кислорода и азота.
Ответ:mO2=0.232; N2=0.768; R=287 Дж/кгК; pN2=0.79Рсм, Па; pO2=0.21Рсм.Па
3.3. Смесь газов состоит из водорода и окиси углерода. Массовая доля водорода mH2=0.067%.
Найти газовую постоянную смеси и ее удельный объем при нормальных условиях.
Решение:
Из уравнения (3.9)
Rсм = Sm i R i =m1 R1+m2 R2=0.0667∙4124+0.9333∙296.8=552 Дж/кгК.
Удельный объем газовой смеси получим из уравнения состояния идеального газа vн = RTн/pн=552∙273/101325=1.49 м3/кг.
Ответ: Rсм =552 Дж/кгК; vн =1.49 м3/кг.
3.4. Определить газовую постоянную смеси газов, состоящей из 1 м3 генераторного газа и 1.5 м3 воздуха, взятых при нормальных условиях, и найти парциальные давления составляющих смеси. Плотность генераторного газа r принять равной 1.2 кг/м3.
Ответ: Rсм=295 Дж/кгК; pгг=0.4Рсм; рвозд=0.6Рсм.
3.5. Объемный состав сухих продуктов сгорания топлива (не содержащих водяных паров) следующий: СО2=12.3%;О2=7.2%;N2=80.5%. Найти кажущуюся молекулярную массу и газовую постоянную , а также плотность и удельный объем продуктов сгорания при В=100кПа и t=800 0C.
Ответ: mсм=30.3; Rсм=274 Дж/кгК; v=2.94 м3/кг; rсм=0.34 кг/м3.
3.6. Найти газовую постоянную, удельный объем газовой смеси и парциальные давления ее составляющих, если объемный состав смеси следующий: СО2=12%; CO=1%; H2O=6%; O2=7%; N2=74%; а общее давление ее р=100 кПа.
Ответ: Rсм=281 Дж/(кг К); v=0.76 м3/кг; рСО2=12000 Па.
3.7. Массовый состав смеси следующий: СО2=18%; O2=12%; N2=70%. До какого давления нужно сжать 8 кг этой смеси, находящейся при нормальных условиях, чтобы при t=180 0С она занимала объем, равный 4 м3.
Ответ: Р=0.24 МПа.
3.8. Определить массовый состав газовой смеси, состоящей из углекислого газа и азота, если известно, что парциальное давление углекислого газа рСО2=120 кПа, а давление смеси рсм=300 кПа.
Ответ: mCO2=0.512; mN2=0.488.
3.9. Газовая смесь имеет следующий массовый состав: СО2=12%; О2=8%; N2=80%. До какого давления нужно сжать эту смесь, находящуюся при нормальных условиях, чтобы плотность ее составляла 1.6 кг/м3?
Ответ: До 0,213 МПа.
Дата добавления: 2014-11-13; просмотров: 2483; Мы поможем в написании вашей работы!; Нарушение авторских прав |