
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гипокоагуляция. Геморрагические синдромы
32.2.1. Геморрагические синдромы сосудистого происхождения
32.2.2. Гемморрагические синдромы тромбоцитарного происхождения
32.2.3. Гемморрагические синдромы плазматического происхождения
32.2.4. Гемморрагические синдромы, обусловленные избыточной активностью противосвертывающей системы
32.2.5. Гемморрагические синдромы, обусловленные избыточной активностью фибринолитической системы
32.2.6. Коагулопатии, обусловленные избыточным потреблением некоторых факторов свертывания
32.2.6.1. Принципы лечения диссеминированного внутрисосудистого свертывания (ДВС)
32.2.6.2. Обязательные тесты для обнаружения синдрома ДВС
Жидкостно – свертывающее равновесие представляет совокупность физиологических процессов, которые, с одной стороны, обеспечивают жидкое состояние крови (функция аутоконсервации), а с другой – останавливают кровотечение из сосудистого русла в случае его повреждения.
Жидкостно – свертывающее равновесие обеспечивается различными, очень сложными физиологическими и биохимическими процессами, но особенно, гармоничным функционированием системы физиологического гемостаза, противосвертывающей и фибринолитической систем.
Физиологический гемеостаз представляет совокупность взаимозависимых, последовательных во времени процессов (адгезия, обратимая агрегация, необратимая агрегация, вязкостная метаморфоза и собственно коагуляция), которая реализует образование сгустка с прекращением кровотечения.
Противосвертывающая система. Запущенный процесс коагуляции, будучи ферментативным каскадом, должен обеспечить трансформацию всего количества фибриногена крови в фибри, т.е., свертывание всей крови. Все же этого не происходит благодаря тому, что существует противосвертывающая система, представленная ингибиторами свертывания - антитромбокиназой, препятствующей образованию тромбина и антитромбина, который, после образования сгустка, абсодбирует остаток тромбина и, одновременно, переводит его в неактивную форму, что препятствует процессу образования сгустков за пределами зоны повреждения сосуда.
Фибринолитическая система представлена совокупностью реакций, которые участвуют в дезинтеграции избытка сгустка (расщепляет нерастворимый полимер фибрина), остающегося неиспользованным после остановки кровотечения. Отметим, что фибринолитическая система не ограничивает осуществление гемостаза в месте нарушения целостности сосудов (в этом месте фибринолиз блокирован), более того, одновременно с окончанием процесса коагуляции, происходит растворение избытка фибрина, что ограничивает, таким образом, распространение образования сгустков во всем кровяном русле.
Эти биохимические процессы, представляют противоположные “ферментные каскады” при участии различных клеточных, тканевых и молекулярных, специфических и неспецифических факторов, катализирующих, активирующих и ингибирующих факторов, разворачивающиеся продолжительно, на отлично уравновешенном количественном уровне, реализуя жидкостно – свертывающего равновесия.
Необходимо заметить, что гемостаз и фибринолиз в физиологических условиях носят защитный характер. Временно возможно преобладание одного из этих 2 процессов, но впоследствии между ними восстанавливается равновесия. Например, гемостатический ответ преобладает при повреждении сосуда, а тромболитический – при образовании микротромба.
Физиологический гемостаз включает первичный гемостаз, в котором участвуют сосуды и тромбоциты, осуществляя временную остановку кровотечения посредством формирования необратимого пристеночного пластиночного тромба и вторичного гемостаза или собственно свёртывания, осуществляемого плазматическими факторами свертывания.
Первичный гемостаз представляет первый этап в процессе тромбогенеза. Основные причины: нарушение целостности сосудистой стенки, физико-химические изменения крови и замедление кровотока.
Этот динамический этап включает так называемый “сосудисто-пластиночный механизм” или “сосудисто-пластиночное время”, которое осуществляет остановку кровотечения из сосудов микроциркуляции.
Сосудистый механизм начинается с повреждения стенки капилляра, которое рефлекторно вызывает его спазм, обусловленный вазоактивными медиаторами (серотонин, адреналин, норадреналин) с замедлением кровотока в этой отдельной зоне, что уменьшает просвет сосуда с замедлением кровотока – условия, необходимые для остановки кровотечения. Сразу после спазма сосудов включается пластиночный механизм с адгезией тромбоцитов к открытому коллагену в месте повреждения стенки капилляра. Так как оба механизма последовательны и взаимозависимы, в некоторых литературных источниках они описываются как единый механизм – сосудисто-пластиночный механизм, характеризующийся адгезией и агрегацией кровяных пластинок.
А д г е з и я – способность пластинок приклеиваться к чужеродным поверхностям (к коллагену). В первую очередь, это происходит благодаря тому, что в месте повреждения коллаген изменяет свой электрический заряд, во вторую очередь гликозилтрансфераза с поверхности мембраны пластинок соединяется с ненасыщенными гликозидными группами коллагена (устанавливается биохимический механизм пластинчатой адгезии). Отметим, что адгезия может быть эффективной только в присутствии фактора Willebrand (часть сложной белковой молекулы VIII плазматического фактора). В результате адгезии происходит усиление активности тромбоцитарной (пластиночной) фосфолипазы, которая вызывает высвобождение арахидоновой кислоты из фосфолипидов мембран тромбоцитов. Посредством циклооксигеназ тромбоцитов арахидоновая кислота переходит в эндопероксиды PGG2, RGH2, которые, в свою очередь, образуют простогландины PGE2, PGD2, простациклин (PGI2) и тромбоксаны TxA и TxB. PGG2 возбуждает сократительный элемент пластинки (тромбостенин). Вследствие сокращения тромбостенина происходит внутреннее сокращение пластинок с высвобождением из них PGG2, АДФ, пластинчатого фактора (Fp4). Явление названо « I выхождение» - release I), которое, в свою очередь, запускает процесс агрегации пластинок.
А г р е г а ц и я. Под действием АДФ, PGG2, PGF2, тромбоксана А2, Fp4 и Fp5 тромбоцитов плотно склеиваются между собой, образуя пристеночный пластиночный сгусток, процесс, названный первичной обратимой агрегацией (рис. 32.1а, 32.1б).
В результате первичной агрегации происходит серия физико-химических изменений тромбоцитов, известных под названием вязкостной пластиночной метаморфозы, характеризующейся образованием псевдоподий, дезинтеграцией, агрегацией и образованием конгломератов тромбоцитов, в которых участвует и незначительное количество тромбина, образованного внешним путем, процесс, названный вторичной агрегацией с образованием необратимого пристеночного белого тромба. Более того, вязкостная метаморфоза ведет к весьма выраженному повышению проницаемости мембраны пластинок с избыточным проникновением плазматического Са2+ в пластинки, приводя к активации АТФ – азы с расщеплением АТФ и выделением энергии. Все это вызывает сильное сокращение тромбостенина, вследствие чего происходит выброс из пластинки целого хромомера с выходом всех пластиночных факторов: Fp1, Fp2, Fp3, Fp6, Fp7, Fp8, Fp9, процесс, названный вторым пластиночным выходом или так называемое « II выхождение» - release II). Это, впоследствии, образует пластиночную атмосферу – фактор, необходимый для запуска следующих этапов гемостаза – собственно коагуляции или “плазматического времени”, называемого и вторичным гемостазом.


 |
Вторичный гемостаз (плазматический механизм) или ферментативная собственно
коагуляция, включает следующие фазы:
а) активация тромбопластина;
б) трансформация протромбина в тромбин под действием тромбопластина;
в) трансформация фибриногена в фибрин под действием тромбина.
Активация тромбопластина (а) и трансформация протромбина в тромбин (б) под действием тромбопластина осуществляется двумя путями:
- в н е ш н и й п у т ь – более быстрый путь активации тромбопластина, который длится (30-40 секунд). Он включает следующие ферментативные процессы:
1) ф. III + ф. VII + цефалин + ионы Са2+ = PI – 1(промежуточный продукт – 1);
2) PI – 1 → ф. Х = ф. Ха;
3) ф. Ха + цефалин = PI – 2 (промежуточный продукт – 2);
4) PI – 2 + ф. V = активный тромбопластин;
5) Активный тромбопластин переводит протромбин в тромбин.
Итак, комплекс, образованный из фактора Ха, V, + цефалин + Са2+ не что иное как незначительное количество активного тромбопластина (протромбиназы), образованное этим путем.
Под действием этого незначительного количества активного тромбопластина в зоне повреждения сосуда из протромбина образуется такое же малое количество тромбина, определяя таким образом вязкосную метаморфозу тромбоцитов с образованием необратимого пристеночного белого тромба.
Итак, необходимо отметить, что тромбин, образованный внешним путем практически не участвует в трансформации фибриногена в фибрин, последняя осуществляется внутренним путем (рис. 32.2..)
- в н у т р е н н и й п у т ь активации тромбопластина протекает намного медленнее (5-10 минут), так как он представляет цепочку ферментных процессов, катализируемых по типу каскада. Механизм активации фактора Х и формирование активного тромбопластина этим путем осуществляется с участием плазматических факторов XII, XI, IX, VIII, V, F3p и ионов Са2+. Он включает следующие ферментные процессы:
1) ф. XIIa + ф. XI + F3p + ф. Fitzgerald = PAC (контактный продукт активации);
2) PAC → ф. IX = ф. IXa;
3) ф. IXa + ф.VIII + PI-1 (промежуточный продукт - 1);
4) PI-1 → ф. X = ф. Xa;
5) ф. Xa + F3p = PI-2 (промежуточный продукт – 2);
6) PI-2 + ф.V = активный тромбопластин (протромбиназа).
Активный тромбопластин образованный внутренним путем, действуя на протромбин, превращает его в 2 молекулы тромбина, в то время как тромбопластин образованный внешним путем – только в одну молекулу.
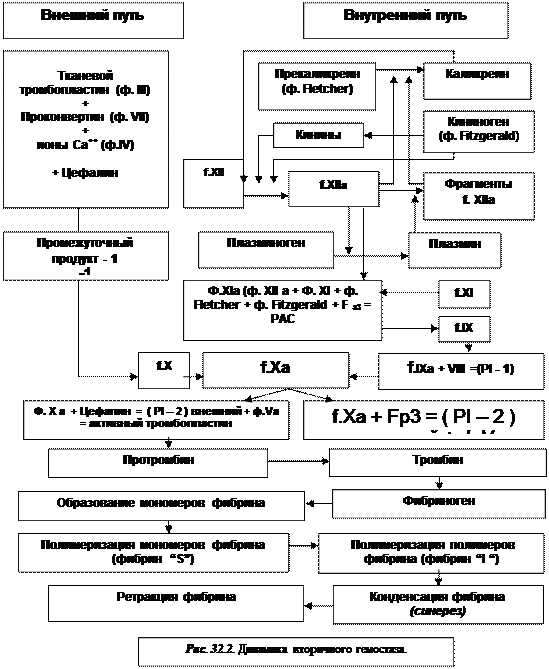 |

в) трансформация фибриногена в фибрин под действием тромбина
Процесс включает следующие этапы:
- формирование мономера фибрина;
- полимеризация мономеров фибрина;
- стабилизация полимера фибрина;
- конденсация и
- ретракция сгустка.
Формирование мономеров фибрина катализируется тромбином с выбросом четырех пептидных фрагментов (пары фибринопептидов А и пары фибринопептидов В).
Полимеризация осуществляется вначале продольно, а потом поперечно, с участием F5р (пластиночный серотонин). Конечный результат полимеризации мономеров фибрина состоит в формировании полимера фибрина, растворимого в растворе мочевины 5М, названного фибрин “S”.
Стабилизация полимера фибрина происходит под действием Ф.XIIIа, который делает полимер фибрина более устойчивым к различным механическим воздействиям. Таким образом, в результате процесса стабилизации происходит формирование так называемого фибрина “I“ (фибрин, нерастворимый в растворе мочевины 5М).
Синерез (осаждение) является следующим этапом, который включает процесс конденсации фибрина посредством интенсивного выделения воды из межмолекулярных пространств геля. Вследствие этого процесса фибринозный сгусток уменьшается в объеме, становясь более гомогенным и устойчивым.
Ретракция представляет конечный этап в образовании сгустка фибрина, характеризующийся выделением сыворотки крови, заключенной между волокнами фибрина. В процессе ретракции особое значение имеет пластиночный тромбопластин, который обеспечивает укорочение и сближение волокон фибрина, придавая сгустку повышенную устойчивость к механическим, химическим и даже ферментным воздействиям – свойства, определяющие эффективный и стабильный гемостаз.
Таким образом, начатая коагуляция, являясь ферментативным процессом, должна обеспечивать трансформацию всего количества фибриногена в фибрин. В то же время это не происходит благодаря тому, что существует противосвертывающая и фибринолитическая системы, которые, прежде всего, ограничивают гемостаз в месте нарушения целостности сосудов (в этом месте фибринолитическая система блокирована). Более того, сразу после окончания процесса свертывания происходит растворение избытка фибрина, ограничивая таким образом распространение образования сгустков в кровяном русле.
Противосвертывающая система включает первичные антикоагулянты и ряд ингибиторов процесса свертывания.
А) Первичные или циркулирующие антикоагулянты: антипротромбиназа и антитромбины. Антипротромбиназа крови уникальна и специфически действует лишь на активный тромбопластин, а антитромбинов различают 4 вида (рис. 32.3).

Рис. 32.3.Первичные или циркулирующие антикоагулянты.
1. А н т и т р о м б и н I (AT I) представляет собственно фибрин, который после образования сгустка абсорбирует остаток тромбина, переводя его в неактивную форму, что препятствует формированию тромба вне зоны поражения сосуда.
2. А н т и т р о м б и н II (AT II) представляет плазматический белок, образующий необратимый комплекс с тромбином, инактивируя его действие. AT II составляет приблизительно 25% всего антитромбинового действия плазмы.
3. А н т и т р о м б и н III (AT III) представляет главный белок плазмы в механизме инактивации тромбина. Он составляет 75% всего антитромбинового действия плазмы. В случае, когда AT III действует самостоятельно, процесс инактивации тромбина происходит медленно, а в присутствии гепарина процесс практически мгновенен. AT III называют кофактором I гепарина.
Механизм инактивации тромбина посредством AT III состоит в формировании необратимого комплекса между молекулой тромбина и AT III. Этот необратимый процесс происходит благодаря химической связи между активным центром тромбина – серином и активным центром AT III - аргинином (активация вызвана гепарином). Отметим, что гепарин обладает и угнетающим действием на процесс адгезии пластинок посредством повышения их отрицательного заряда, что приводит к запаздыванию, замедлению сосудисто-пластиночного времени. AT III обладает ингибирующим действием и на плазматические факторы гемостаза: VII, IX, X, XI, XII, калликреин и плазмин (рис. 32.4).
 |
4. А н т и т р о м б и н IV (AT IV) - это продукты распада фибрина (PDF), которые, действуя на мономеры фибрина, приводят к блокированию его полимеризации, препятствует трансформации фибриногена в фибрин, образуют аномальные полимеры, угнетают скопление и агрегацию пластинок.
В) Антифакторы представляют патологические ингибиторы, формирующиеся в результате иммунных механизмов. Например, антифактор VIII и антифактор IX, обнаруживаемые соответственно при гемофилии А и В. Эти антифакторы могут образовываться вследствие повторных длительных трансфузий плазматических концентратов, содержащих ф. VIII или ф. IX. Антифакторами могут быть и:
- ингибиторы активации протромбиназы (антифакторы XII, XI, IX, VIII, VII);
- ингибиторы активации протромбина (антифакторы V, X);
- ингибиторы трансформации фибриногена в фибрин и т.д.
Обнаружены и антифакторы к тромбопластину, к Ф. III, IX, XII, XIII и т.д. Антикоагулянтным действием обладает и так называемый протеин С, который препятствует активации плазматических факторов (V и VIII) (рис. 32.5)

Фибринолитическая система. Фибринолиз может быть физиологическим и патологическим.
Физиологический фибринолиз запускается физиологическим фибриногенезом, строго ограниченным растворением сгустка и ферментативным разложением избытка фибрина, завершая, таким образом, процесс физиологического гемостаза.
Патологический фибринолиз представляет генерализацию фибринолитических реакций, появляющуюся вследствие наводнения организма активаторами, в условиях, в которых ингибирующие механизмы становятся недостаточным как количественно, так и качественно. Таким образом, циркулирующий плазмин выполняет выраженное ферментативное действие, определяя возникновение тяжелого протеолитического синдрома.
Основным компонентом фибринолитической системы является плазмин (фибринолизин), обладающий сильным гидролизирующим действием по отношению к фибриногену, фибрину, к факторам свертывания V, VII, IX и протромбину.
Плазмин формируется из неактивных предшественников (плазминогена) под действием тканевых и плазматических активаторов.
Плазматическими активаторами могут быть ф.XII, урокиназа, стрептокиназа и C1q.
Тканевые активаторыфибринолитической системы присутсвуют во всех тканях, но в большом количестве обнаруживается в матке, почках, простате, легких, лимфатических узлах. Основным источником фибринокиназ является эндотелий сосудов.
Ингибиторами процесса фибринолиза являются антифибринокиназы, ингибиторы протеаз (контрикал), а также комплекс гепарин – антитромбин. Процесс фибринолиза включает два этапа:
а) активация плазминогена путем перевода его в активный плазмин и
б) протеолитическое разрушение фибрина.
а) Активация плазминогена с включением процесса фибринолиза происходит под действием следующих причин: физический или психический стресс, гипоксия и некроз клеток и тканей, венозный стаз, травматизм сосудов, все состояния, сопровождаемые гиперсекрецией катехоламинов, химических медиаторов, биогенных аминов и др. (рис. 32.6.)
б) Распад фибрина происходит посредством действия плазмина на молекулу фибрина или фибриногена, разрушая ее на серию полипептидов, называемых продуктами распада фибрина (PDF).
Процесс дезинтеграции фибрина проходит в 3 этапа.
На первом этапе от фибрина отделяются два маленьких сегмента из цепи α и два сегмента из цепи β. Остается один большой сегмент, называемый фрагмент Х.
 |
На втором этапе от фрагмента Y отделяется сегмент D и остается сегмент Y.
На третьем этапе от фрагмента Y отделяются фрагменты Е и D.
Таким образом, из одной молекулы фибриногена последовательно образуется пять фрагментов (Х, Y, Е, 2 D), названные продуктами распада фибрина (РDF).
Продемонстрировано, что умеренная активация фибринолитической системы всегда сопровождается усилением процесса свертывания. Если же имеет место выраженная и длительная активация фибринолитической деятельности, это, впоследствии, напротив, вызывает выраженную гипокоагуляцию. Этот механизм очень сложен и относится ко всем фазам процесса свертывания.
Например, продукт распада фибрина на первом этапе (фрагмент Х) препятствует образованию протромбиназы, а плазмин разрушает плазматические факторы V и VIII, что приводит к блокированию формирования тромбина.
Продукт распада фибрина на II этапе (фрагмент Y) угнетает трансформацию фибриногена в фибрин.
Продукты распада фибрина на III этапе – фрагмент D – угнетает полимеризацию мономера фибрина, фрагмент Е угнетает агрегацию пластинок, а плазмин оказывает литическое действие и на фибриноген, что, в совокупности, препятствует всем фазам тромбогенеза. Отметим, что фрагменты Х и Y более активны, чем D и Е (рис. 32.7).
В патологических условиях под действием разных причин могут обнаруживаться следующие нарушения равновесия между фибринообразованием и фибринолизом:
а) развитие гиперкоагуляции, тромботического синдрома с ускоренным образованием фибрина (тромб формируется и в неповрежденных сосудах);

Рис. 32.7. Патогенетические механизмы гипокоагуляции
б) развитие геморрагических синдромов, появляющихся в результате процесса гипокоагуляции (тромб не образуется и кровотечение не останавливается), или в результате вторичного фибринолиза (образованный тромб легко разрушается и кровотечение восстанавливается);
в) парадоксальное сочетание тромбозов и кровотечений, с развитием тромбогеморрагического синдрома, называемого и коагулопатией потребления или диссеминированном внутрисосудистом свертыванием (ДВС)
Дата добавления: 2014-12-23; просмотров: 449; Мы поможем в написании вашей работы!; Нарушение авторских прав |