
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нуклеофильное присоединение синильной кислоты, бисульфита натрия, реактива Гриньяра, ацетиленидов
В карбонильном соединении атом углерода плоский, легко доступен для атаки нуклеофила сверху или снизу от этой плоскости (I).

В переходном состоянии (II) нуклеофил, подавая электроны на атом углерода, начинает образовывать с ним s-связь, а кислород приобретает электроны, атом углерода становится близок к тетраэдрическому. Продукт реакции присоединения (III) - ион, в котором атом углерода находится в sр3-гибридном состоянии - тетраэдр, на кислороде - целый отрицательный заряд. Именно способность кислорода нести отрицательный заряд обусловливает реакционную способность карбонильных соединений по отношению к нуклеофилам. Стабилизация полученного иона происходит за счет присоединения протона воды или кислоты (IV).
|

В том же направлении действуют и электронные факторы. Алкильные группы проявляют электронодонорный индукционный эффект, дестабилизируют переходное состояние, увеличивая отрицательный заряд на атоме углерода, который подвергается атаке нуклеофила.
Присоединение цианид-иона. Цианистый водород присоединяется ко многим альдегидам и кетонам, образуя циангидрины.

Реакцию проводят, добавляя минеральную кислоту к смеси карбонильного соединения и цианистого натрия, количество добавляемой кислоты должно быть недостаточным для связывания всех цианид-ионов.

|

Присоединение бисульфита. Бисульфит натрия присоединяется к большинству альдегидов и метилкетонов.

Эту реакцию используют для очистки карбонильных соединений: полученный кристаллический продукт отделяют от некарбонильных примесей и добавлением кислоты или основания регенерируют карбонильное соединение.

Присоединение реактива Гриньяра. Реактивы Гриньяра присоединяются к альдегидам и кетонам быстро и необратимо.

Органический остаток, переносимый с парой электронов на углерод карбонильной группы, является сильным нуклеофилом. Другая молекула  действует как кислота Льюиса, облегчает присоединение нуклеофила СН3y.
действует как кислота Льюиса, облегчает присоединение нуклеофила СН3y.
Присоединение ацетиленидов. Альдегиды и кетоны реагируют с ацетиленидом натрия, образуя алкоксиды натрия, гидролиз которых приводит к образованию спиртов, содержащих тройную связь.
|

5.2.2. Нуклеофильное присоединение - отщепление G–NH2 и спиртов
C альдегидами и кетонами взаимодействуют соединения, родственныеаммиаку  и спирты
и спирты  в этом случае реакция протекает как нуклеофильное присоединение с последующим отщеплением воды.
в этом случае реакция протекает как нуклеофильное присоединение с последующим отщеплением воды.


Примеры нуклеофильных реагентов и продуктов взаимодействия приведены ниже.

Поскольку нуклеофил слабый (частица, не имеющая заряда), его присоединение катализируется кислотой. Предварительное протонирование карбонильного соединения делает его более реакционноспособным: на карбонильном углероде увеличивается положительный заряд (I), что позволяет кислороду приобрести пару электронов в результате нуклеофильной атаки, не получая при этом отрицательного заряда (II).
|



Продукты присоединения (IV) содержат группу с двойной связью  , образующуюся в результате элиминирования молекулы воды из первоначального аддукта (II).
, образующуюся в результате элиминирования молекулы воды из первоначального аддукта (II).
Следует учесть, что производные аммиака  и спирты
и спирты  являются основаниями и взаимодействуют с кислотами, теряя приэтом способность реагировать как нуклеофилы.
являются основаниями и взаимодействуют с кислотами, теряя приэтом способность реагировать как нуклеофилы.
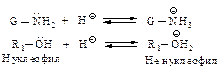
Кислотность среды, при которой присоединение будет протекать легче всего, определяется основностью реагента и реакционной способностью карбонильного соединения: раствор должен быть настолько слабокислым, чтобы значительное количество реагента оставалось не протонированным, и настолько сильнокислым, чтобы сделать достаточно реакционноспособным карбонильное соединение.
Взаимодействие с гидроксиламином. Перегруппировка Бекмана. Продуктом взаимодействия альдегида или кетона с гидроксиламином является оксим. Скорость образования оксима максимальна при рН ~ 4.
|

Ранее оксимы применяли главным образом для идентификации альдегидов и кетонов. Однако они представляют интерес и для органического синтеза. Например, восстановлением оксимов могут быть получены первичные амины.

Оксимы при действии на них кислот превращаются в замещенные амиды кислот (перегруппировка Бекмана).

Сначала происходит протонирование оксима (I) и отщепление воды. Синхронно с отщеплением воды к атому азота из анти-положения мигрирует радикал R1. Карбокатион (II) захватывает молекулу воды с образованием оксоний-иона (III). Промежуточное соединение с гидроксилом у углерода при двойной связи (IV) перегруппировывается в амид (V).
Бекмановская перегруппировка имеет промышленное значение при получении капролактама, используемого для получения высокомолекулярного поликапроамида – капрона (см. п. 10.2).

Взаимодействие со спиртами, образование ацеталей. Альдегид в безводном спирте, содержащем небольшое количество безводной кислоты, обычно хлористого водорода, превращается в ацеталь.
|

Воду удаляют по мере ее образования в виде азеотропа с бензолом и этиловым спиртом (Ткип. = 64,9 оС).
Присоединение одной молекулы спирта приводит к образованию полуацеталя.


Полуацеталь представляет собой спирт и простой эфир одновременно, в присутствии кислот полуацеталь как спирт реагирует со второй молекулой спирта.


|
Первичные ароматические амины взаимодействуют с ароматическими альдегидами с образованием оснований Шиффа.
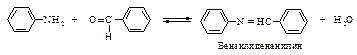
Эти реакции не требуют катализатора.
Реакция ароматических альдегидов с ароматическими аминами используют для защиты аминогруппы, так как полученные соединения легко гидролизуются в кислой среде с образованием исходных альдегида и амина.
Шиффовы основания, образовавшиеся при взаимодействии первичных ароматических аминов с алифатическими альдегидами, неустойчивы и легко полимеризуются.
5.2.3. Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация
Под влиянием карбонильной группы атомы водороды, находящиеся в a-положении к карбонилу, приобретают кислый характер и могут отщепляться в виде протонов под влиянием основания.

Отщепление a-водородного атома в виде протона под влиянием основания приводит к устойчивому карбаниону, который можно представить резонансным гибридом двух граничных структур (I и II). Ионизация b, g - водородных атомов невозможна, так как образующиеся при этом карбанионы были бы крайне нестабильными (в распределении заряда карбонильный кислород не участвует). Образующийся карбанион является очень реакционноспособным нуклеофилом.
Способность кислорода принимать отрицательный заряд обусловливает и кислотность a-водородных атомов и склонность карбонильных соединений к реакциям нуклеофильного присоединения в присутствии оснований.
|
 -группе, и источником карбанионов – нуклеофилов.
-группе, и источником карбанионов – нуклеофилов.

При нагревании реакционной смеси альдоль дегидратируется в ненасыщенный альдегид.

Легкость протекания и направление реакции дегидратации обусловлены устойчивостью образующегося алкена: двойная углерод–углеродная связь сопряжена с двойной углерод-кислородной связью карбонила. В тех случаях, когда в образующихся алкенах в систему сопряжения включено ароматическое кольцо, альдоль выделить не удается.
Механизм альдольной конденсации включает следующие стадии:
1 стадия – образование карбаниона – нуклеофила:

2 стадия – нуклеофильное присоединение:
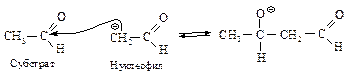
|

Если карбонильное соединение не содержит a-водородного атома, то простой альдольной конденсации не происходит.

Перекрестная альдольная конденсация – это альдольная конденсация двух различных карбонильных соединений, одно из которых не содержит a-водородного атома.
Для того, чтобы в результате альдольной конденсации получить хороший выход индивидуального продукта, карбонильную компоненту – реагент, не содержащий a-водородных атомов, смешивают с катализатором и к этой смеси прибавляют метиленовую компоненту, содержащую водород у a-углерода.

Метиленовой компонентой может быть соединение, содержащее водород, активированный электроноакцепторной группой (табл. 3.).
|
Реакции, родственные альдольной конденсации
| Карбонильная компонента | Метиленовая компонента | Продукт реакции |

| 
| 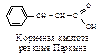
|

| 
| 
|

| 
| 
|

| 
| 
|

| 
| 
|
5.2.4. Нуклеофильное присоединение – реакция окисления-восстановления
Альдегиды, в которых отсутствуют a-водородные атомы, вступают в реакцию окисления-восстановления в присутствии сильного основания – реакция Канниццаро.

Несмотря на кажущееся отличие этого превращения от рассмотренных ранее, реакция Канниццаро представляет собой ряд последовательных стадий нуклеофильного присоединения:
|
2 стадия – превращение иона (I) в молекулу кислоты путем отщепления от него гидрид-иона Нy, который является нуклеофилом в реакции присоединения ко второй молекуле альдегида (II), при этом анион (I) превращается в муравьиную кислоту (III);
3 стадия – перенос протона от более слабого основания формиат-иона к более сильному метоксид-иону (IV).
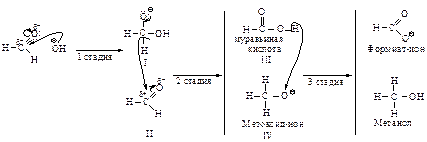
Как правило, смесь двух альдегидов в реакции Канниццаро дает набор всех возможных продуктов. Однако если одним из альдегидов будет формальдегид, то образуется почти исключительно формиат натрия и спирт, соответствующий другому альдегиду.
Дата добавления: 2014-12-30; просмотров: 639; Мы поможем в написании вашей работы!; Нарушение авторских прав |