
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электрофильное замещение в ядре
Благодаря электронодонорному эффекту сопряжения группа ОН фенола очень сильно активирует кольцо в реакциях электрофильного замещения.

Карбокатионы, представленные структурами (I) и (II), достаточно устойчивы и легко образуются. В том случае, если атаке электрофила подвергается феноксид-ион С6Н5Оy, промежуточный σ-комплекс представляет собой нейтральную частицу (III) или (IV), еще более устойчивую и еще быстрее образующуюся.
|

Галогенирование. Реакции фенолов с галогенами проводят без катализаторов. При обработке фенола бромной водой происходит замещение атомов водорода в о-и п-положениях, поскольку в водном растворе в реакцию электрофильного замещения вступает феноксид-ион С6Н5Оy.

Галогенирование в растворителе низкой полярности (ОН группа не ионизирована) приводит к продукту моногалогенирования.

Нитрование. Продукты мононитрования разбавленной азотной кислотой – о- и п-нитрофенолы.

Полученные изомеры легко разделяются. о-Нитрофенол имеет более низкую растворимость в воде, более низкую температуру кипения и, кроме того, легко перегоняется с водяным паром.
|

Нагревание фенола с серной кислотой и последующая обработка полученной 2,4-фенолдисульфоновой кислоты азотной кислотой – более удобный способ получения пикриновой кислоты по сравнению с реакцией прямого нитрования.
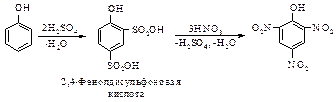
Реакция замещения группы G, ранее введенной в ароматическое кольцо, в отличие от замещения водорода, называется реакцией ипсо-замещения. В последнем примере при ипсо-замещении сульфогруппа замещается на нитрогруппу.
Сульфирование фенола при комнатной температуре приводит главным образом к получению о-изомера (кинетически контролируемый продукт), а при повышенной температуре – п-изомера (термодинамически контролируемый продукт).

|

С-ацилирование. Реакции Фриделя-Крафтса в присутствии хлорида алюминия с фенолом не проводят. Причиной этого служат комплексообра-зование А1С1з по гидроксильной группе и потеря каталитической активности катализатора. Однако С-ацилирование фенола и его производных возможно в присутствии других катализаторов. Например, обработка фенола уксусной кислотой в присутствии ВF3 дает п-гидроксиацетофенон с выходом, близким к количественному.

Реакция Кольбе-Шмитта. Синтез фенолкарбоновых кислот. Двуокись углерода реагирует с феноксидом натрия при нагревании и под давлением. В зависимости от температуры образуются орто- или пара-изомеры натриевой соли о-оксибензойной (салициловой) кислоты. При температуре 125 оС образуется орто- изомер, при 250 °С - пара-изомер.

Реакцию Кольбе-Шмитта применяют в промышленности также для получения п-аминосалициловой и гидроксинафтойных кислот.
Сочетание с солями диазония - образование азосоединений. Реакция азосочетания с феноксид-ионами также протекает по механизму элек-трофильного ароматического замещения (SЕАr) и широко применяется в производстве красителей.
|

Реакция с формальдегидом - фенолформальдегидные смолы. В реакции фенола с формальдегидом (механизм реакции SЕАr) в присутствии щелочи или кислоты образуется фенолформальдегидная смола - высокомолекулярное вещество, в котором фенольные кольца связаны посредством групп –СН2–.
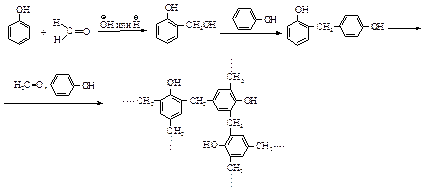
Из производных фенола, содержащих заместители в орто- или пара-положениях (например, из п-крезолов), могут получаться смолы только линейного строения.
Первая стадия образования полимера представляет собой электрофильное замещение в о- и п-положениях фенола. Основания катализируют реакцию, превращая фенол в более реакционноспособный феноксид-ион.

Кислота катализирует реакцию за счет протонирования формальдегида и уменьшения электронной плотности на углероде.

|
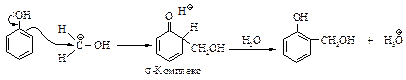
Реакция Реимера-Тимана. Синтез ароматических альдегидов, содержащих ОН-группу. Обработка фенола хлороформом и водным раствором щелочи приводит к введению альдегидной группы -СНО в ароматическое кольцо в орто-положение к -ОН-группе.
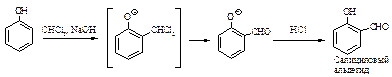
Вначале образуется замещенный бензальхлорид, который далее гидролизуется в щелочной среде.
Реакция Реймера-Тимана включает стадию электрофильного замещения в очень активном кольце феноксид-иона, электрофилом служит дихлорметилен: СCl2 (карбен), генерируемый из хлороформа.


Хотя дихлоркарбен электрически нейтрален, он содержит атом углерода, несущий лишь секстет электронов и поэтому являющийся сильным электрофилом.
Дата добавления: 2014-12-30; просмотров: 691; Мы поможем в написании вашей работы!; Нарушение авторских прав |