
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислотность
Фенолы более сильные кислоты, чем вода (Ка~10-16) и спирты (Ка~10-18), но значительно более слабые, чем карбоновые кислоты (Kа~10-5). Большинство фенолов имеют Ка~10-10. Гидроксигруппа, связанная с ароматическим ядром, является более кислой, чем группа ОН в воде и спирте, вследствие делокализации электронной пары феноксид-иона, изображенной с помощью граничных структур I - IV.

|

Ряд изменения кислотности и основности можно представить следующим образом:
Относительная основность: 
Относительная кислотность: 
Влияние заместителей на кислотность фенолов
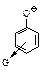 G – электроноакцепторная группа: –NO2,–Hal,
G – электроноакцепторная группа: –NO2,–Hal,  ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность ;
оттягивает электроны, способствует распределению заряда, уменьшает основность феноксид-иона, увеличивает кислотность
|  G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
G – электронодонорная группа: –СН3, –С2Н5;
подает электроны, увеличивает электронную плотность на кислороде, повышает основность феноксид-иона, уменьшает кислотность
|
Повышенная кислотность фенолов по сравнению с водой и со спиртами проявляется в способности фенолов образовывать с водными растворами щелочей и спиртовыми растворами алкоксидов соли, называемые феноксидами (фенолятами).

|

Нерастворимое в воде соединение, которое растворяется в водном растворе щелочи, но не растворяется в водном растворе гидрокарбоната, с большой долей вероятности является фенолом.
Способность фенолов растворяться в водных растворах щелочей используют для выделения фенолов из смесей с нейтральными или менее кислыми соединениями, а также как качественную реакцию на фенол.
Большинство фенолов (как и енолов) дают характерное окрашивание с водным и спиртовым раствором хлорида железа (III) FеС13 вследствие образования комплексных солей железа(цветная качественная реакция на фенолы). При этом фенол окрашивается в красно-фиолетовый цвет, крезол - в синий, резорцин - в темно-фиолетовый, а салициловая кислота 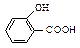 - в красный цвет.
- в красный цвет.
2.2.2. Фенолы и феноксид-ионы – нуклеофильные реагенты
Образование простых эфиров - О-алкилирование фенолов. Реакции фенолов, в которых происходит разрыв связи О-Н и образование новых связей с углеродом, сходны с соответствующими реакциями спиртов. Фенолы как нуклеофилы не реагируют даже с самыми реакционноспособными галогеналканами. Феноксид-ион реагирует с галогеналканами, алкилсульфатами, способными вступать в реакции SN2, с образованием простых эфиров (реакция Вильямсона).
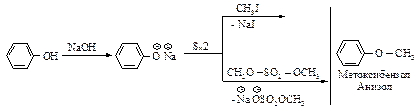
Образование сложных эфиров - О-ацилирование фенолов. Как и спирты, фенолы можно превратить в сложные эфиры реакцией с ангидридами и галогенангидридами карбоновых и сульфоновых кислот.
|

При нагревании сложных эфиров фенолов с хлористым алюминием происходит перемещение ацильной группы  в о- или п-положениекольца с образованием ароматического кетона(перегруппировка Фриса).
в о- или п-положениекольца с образованием ароматического кетона(перегруппировка Фриса).

Дата добавления: 2014-12-30; просмотров: 524; Мы поможем в написании вашей работы!; Нарушение авторских прав |