
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярно-кинетическая теория
Краткая теория
 Относительная молекулярная (атомная) масса – отношение массы молекулы (атома)
Относительная молекулярная (атомная) масса – отношение массы молекулы (атома) 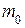 данного вещества к
данного вещества к 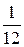 массы атома углерода
массы атома углерода  (изотопа 12С):
(изотопа 12С):
 .
.
 Моль – количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в 0.012 кг углерода 12С.
Моль – количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в 0.012 кг углерода 12С.
 В одном моле любого вещества содержится одно и то же число молекул или атомов,которое называется числом (постоянной) Авогадро. Число Авогадро равно
В одном моле любого вещества содержится одно и то же число молекул или атомов,которое называется числом (постоянной) Авогадро. Число Авогадро равно
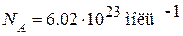
 Количество вещества ν – число молей, равное отношению числа молекул N к числу Авогадро:
Количество вещества ν – число молей, равное отношению числа молекул N к числу Авогадро:
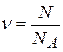 .
.
 Молярная массаµ – масса одного моля вещества:
Молярная массаµ – масса одного моля вещества:
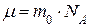 ,
,
где 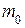 – масса одной молекулы;
– масса одной молекулы;  – число Авогадро. Поскольку масса вещества – это произведение массы одной молекулы на их количество:
– число Авогадро. Поскольку масса вещества – это произведение массы одной молекулы на их количество:  , то количество вещества равно:
, то количество вещества равно:
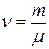 .
.
 Относительная молекулярная масса вещества:
Относительная молекулярная масса вещества:
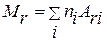 ,
,
где ni – число атомов i-го химического элемента, входящего в состав молекулы данного вещества;  – относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д. И. Менделеева.
– относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д. И. Менделеева.
 Связь молярной массы с относительной молекулярной массой:
Связь молярной массы с относительной молекулярной массой:
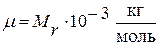 .
.
 Давление, производимое газом на стенки сосуда:
Давление, производимое газом на стенки сосуда:
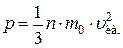 ,
,
где n – концентрация молекул; 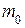 – масса одной молекулы;
– масса одной молекулы; 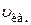 – средняя квадратичная скорость молекул.
– средняя квадратичная скорость молекул.
 Концентрация молекул – число молекул в единице объёма:
Концентрация молекул – число молекул в единице объёма:
 .
.
 Средняя квадратичная скорость (по определению):
Средняя квадратичная скорость (по определению):
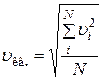 ,
,
где N – число молекул; суммирование происходит по всем молекулам. Или:
 ,
,
где 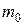 – масса молекулы;
– масса молекулы; 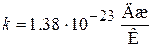 – постоянная Больцмана; Т – термодинамическая температура µ – молярная масса газа;
– постоянная Больцмана; Т – термодинамическая температура µ – молярная масса газа; 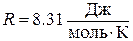 – универсальная газовая постоянная.
– универсальная газовая постоянная.
 Универсальная газовая постоянная равна
Универсальная газовая постоянная равна
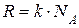 ,
,
где k – постоянная Больцмана;  – число Авогадро.
– число Авогадро.
 Уравнение состояния идеального газа (уравнениеМенделеева-Клапейрона:
Уравнение состояния идеального газа (уравнениеМенделеева-Клапейрона:
 , или
, или 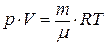 ,
,
где m – масса газа; µ – его молярная масса; Т – термодинамическая температура; 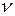 – количество вещества; R – универсальная газовая постоянная.
– количество вещества; R – универсальная газовая постоянная.
 Термодинамическая температура (температура по шкале Кельвина):
Термодинамическая температура (температура по шкале Кельвина):
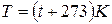 ,
,
где t – температура в градусах Цельсия.
 Давление газа равно:
Давление газа равно:
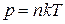 ,
,
где k – постоянная Больцмана; n – концентрация молекул, Т термодинамическая температура.
 Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений входящих в смесь газов:
Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений входящих в смесь газов:
 ,
,
где 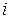 – номер компоненты смеси;
– номер компоненты смеси; 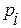 – её парциальное давление, то есть то давление, которое производил бы данный сорт газа, если бы только один занимал весь объём, равный полному объёму смеси; K – число компонентов смеси.
– её парциальное давление, то есть то давление, которое производил бы данный сорт газа, если бы только один занимал весь объём, равный полному объёму смеси; K – число компонентов смеси.
 Массовая доля i-го компонента смеси газов
Массовая доля i-го компонента смеси газов
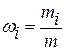 ,
,
где mi – масса i-го компонента смеси; m – масса смеси.
 Основное уравнение молекулярно-кинетической теории
Основное уравнение молекулярно-кинетической теории
– для давления:
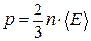 ;
;
– для температуры:
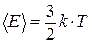 ,
,
где 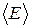 – средняя кинетическая энергия поступательного движения молекул газа.
– средняя кинетическая энергия поступательного движения молекул газа.
 Теорема о равнораспределении энергии по степеням свободы. На любую степень свободы приходится в среднем одинаковая энергия, равная
Теорема о равнораспределении энергии по степеням свободы. На любую степень свободы приходится в среднем одинаковая энергия, равная
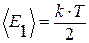 .
.
 Число степеней свободы
Число степеней свободы 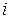 равно числу независимых координат, однозначно определяющих положение тела (или молекулы) в пространстве. Для одноатомных молекул
равно числу независимых координат, однозначно определяющих положение тела (или молекулы) в пространстве. Для одноатомных молекул 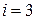 , для двухатомных
, для двухатомных  , для произвольных жёстких многоатомных –
, для произвольных жёстких многоатомных –  .
.
 Средняя энергия одной молекулы, у которой
Средняя энергия одной молекулы, у которой 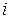 степеней свободы, равна
степеней свободы, равна
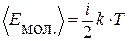 .
.
 Внутренняя энергия U идеального газа:
Внутренняя энергия U идеального газа:
 ,
,
где i – число степеней свободы молекул газа.
Дата добавления: 2014-10-31; просмотров: 330; Мы поможем в написании вашей работы!; Нарушение авторских прав |