
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Силы взаимодействия молекул
Молекулярные силы. Между молекулами вещества существуют силы взаимодействия, называемые молекулярными силами. Если бы между молекулами не было сил притяжения, то все вещества при любых условиях находились бы только в газообразном состоянии. Лишь благодаря силам притяжения молекулы удерживаются друг возле друга и образуют жидкие и твердые тела.
Однако одни только силы притяжения не могут обеспечить существование устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами действуют силы отталкивания.
Строение атомов и молекул. Атом, а тем более молекула, – это сложная система, состоящая из отдельных заряженных частиц – электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними на малых расстояниях действуют значительные электрические силы. Происходит взаимодействие между электронами и ядрами соседних молекул. Описание движения частиц внутри атомов и молекул и сил взаимодействия между молекулами очень сложная задача. Ее рассматривают а атомной физике. Мы приведем только результат: примерную зависимость силы взаимодействия двух молекул от расстояния между ними.
Атомы и молекулы состоят из заряженных частиц противоположных знаков заряда. Между электронами одной молекулы и атомными ядрами другой действуют силы притяжения. Одновременно между электронами обеих молекул и между их ядрами действуют силы отталкивания.
Вследствие электрической нейтральности атомов и молекул молекулярные силы являются короткодействующими. На расстояниях, превышающих размеры молекул в несколько раз, силы взаимодействия между ними практически не сказываются.
Зависимость молекулярных сил от расстояния между молекулами. Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция силы взаимодействия между ними на прямую, соединяющую центры молекул. На расстояниях, превышающих 2-3 диаметра молекул, сила отталкивания практически равна нулю. Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро возрастает, когда электронные оболочки атомов начинают перекрываться. В результате на сравнительно больших расстояниях молекулы притягиваются, а на малых отталкиваются.
На рисунке 8 изображена примерная зависимость проекции силы отталкивания от расстояния между центрами молекул (верхняя кривая), проекции силы притяжения (нижняя кривая) и проекция результирующей силы (средняя кривая). Проекция силы отталкивания положительна, а проекция силы притяжения отрицательна. Тонкие вертикальные линии проведены для удобства выполнения сложения проекций сил.

На расстоянии r0, равном примерно сумме радиусов молекул, проекция результирующей силы Fr = 0, так как сила притяжения равна по модулю силе отталкивания (рис. 9, а). При r > r0 сила притяжения превосходит силу отталкивания и проекция результирующей силы (жирная стрелка) отрицательна (рис 9, б). Если r → ∞, то Fr → 0. На расстояниях r < r0 сила отталкивания превосходит силу притяжения (рис. 9, в).
Происхождение сил упругости. Зависимость сил взаимодействия молекул от расстояния между ними объясняет появление силы упругости при сжатии и растяжении тел. Если пытаться сблизить молекулы на расстояние, меньшее r0, то начинает действовать сила, препятствующая сближению. Наоборот, при удалении молекул друг от друга действует сила притяжения, возвращающая молекулы в исходное положение после прекращения внешнего воздействия.
При малом смешении молекул из положений равновесна сила притяжения или отталкивания растут линейно с увеличением смещения. На малом участке кривую можно считать отрезком прямой (утолщенный участок кривой на рис 8). Именно поэтому при малых деформациях оказывается справедливым закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях молекул закон Гука уже несправедлив.
Так как при деформации тела изменяются расстояния между всеми молекулами, то на долю соседних слоев молекул приходится незначительная часть общей деформации. Поэтому закон Гука выполняется при деформациях в миллионы раз превышающих размеры молекул.
3!ГАЗООБРАЗНОЕ СОСТ.
ЖИДКОЕ СОСТ.
ТВЕРД СОСТ.
4! ГА́З (франц. gaz, от греч. chaos — хаос) , агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет и т. д. состоят из газов, или нейтральных, или ионизованных (плазмы) . Газы широко распространены в природе: они образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов. Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на насколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры. Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия газов развивались медленно. Только в 17 в. было доказано, что воздух обладает весом (Э. Торричелли и Б. Паскаль) . Тогда же Я. ван Гельмонт ввел термин газы для обозначения воздухоподобных веществ. И только к середине 19 в. были установлены основные закономерности, которым подчиняются газы. К ним относятся закон Бойля — Мариотта, закон Шарля, закон Гей-Люссака, закон Авогадро. Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия. Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом. Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах. Уравнение pV=RT называют уравнением состояния идеального газа. Оно было получено в 1834 Б. Клапейроном и обобщено Д. И. Менделеевым для любой массы газа. Входящая в это уравнение газовая постоянная R равна 8,31 Дж/моль. град. Уравнение Клапейрона — Менделеева справедливо только для идеальных газов. Для них выполняется также закон Дальтона. Молекулярно-кинетическая теория газов рассматривает газы как совокупность слабо взаимодействующих частиц (молекул или атомов) , находящихся в непрерывном хаотическом (тепловом) движении. На основе этих простых представлений кинетической теории удается объяснить основные физические свойства газов, особенно полно — свойства разреженных газов. У достаточно разреженных газов средние расстояния между молекулами оказываются значительно больше радиуса действия межмолекулярных сил. Так, например, при нормальных условиях в 1 см3 газа находится ~ 1019 молекул и среднее расстояние между ними составляет ~ 10-6 см. С точки зрения молекулярно-кинетической теории давление газов является результатом многочисленных ударов молекул газа о стенки сосуда, усредненных по времени и по стенкам сосуда. При нормальных условиях и макроскопических размерах сосуда число ударов об 1см2 поверхности составляет примерно 1024 в секунду. Любое вещество можно перевести в газообразное состояние соответствующим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически изображают в переменных: давление р — температура Т (на р-Т-диаграмме) . Существует критическая температура Тк, ниже которой эта область ограничена кривыми сублимации (возгонки) и парообразования
5! Число Авогадро:
6,02214129(27)·10²³ моль⁻¹
6!Ва́куум (от лат. vacuus — пустой) — пространство, свободное от вещества. В технике и прикладной физике под вакуумом понимают среду, содержащую газ при давлении значительно ниже атмосферного[1]. Вакуум характеризуется соотношением между длиной свободного пробега молекул газа λ и характерным размером среды d. Под d может приниматься расстояние между стенкамивакуумной камеры, диаметр вакуумного трубопровода и т. д. В зависимости от величины соотношения λ/d различают низкий ( 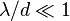 ), средний (
), средний (  ) и высокий (
) и высокий (  ) вакуум.
) вакуум.
7! Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна) .
Классический идеальный газ.
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
объём частицы газа равен нулю (то есть, диаметр молекулы пренебрежимо мал по сравнению со средним расстоянием между ними,) ;
импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях) ;
суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
где — давление, — концентрация частиц, — постоянная Больцмана, — абсолютная температура.
Равновесное распределение частиц классического идеального газа по состояниям описывается распределением Больцмана:
где — среднее число частиц, находящихся в -ом состоянии с энергией, а константа определяется условием нормировки:
где — полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
Для любого идеального газа справедливо соотношение Майера:
где — универсальная газовая постоянная, — молярная теплоемкость при постоянном давлении, — молярная теплоемкость при постоянном объёме.
8!
 - основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его молекул о стенки сосуда. Это же уравнение в другой записи: - основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его молекул о стенки сосуда. Это же уравнение в другой записи: 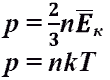
| ||
9!Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году Шарлем и уточнена Гей-Люссаком в 1802 .Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:

или

где:
P — давление газа,
T — температура газа (в градусах Кельвина),
k — константа.
Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление.
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:

Дата добавления: 2015-01-19; просмотров: 799; Мы поможем в написании вашей работы!; Нарушение авторских прав |