
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Объединенный газовый закон
Объединенный газовый закон
Объединяя законы Бойля - Мариотта и Гей-Люссака (уравнения 1 и 2), можно получить следующее уравнение:
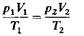 (3)
(3)
которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления.
Объединенный газовый закон можно также записать в другой форме:

Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
R = 8,314 Дж*К* моль-1
Объединенный газовый закон для одного моля газа приобретает вид
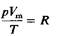
где Vm- объем одного моля газа. Для п молей газа получается уравнение
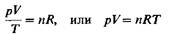 (4)
(4)
В такой форме объединенный газовый закон называется уравнением состояния идеального газа. Уравнение состояния это уравнение, связывающее между собой параметры состояния газа-давление, объем и температуру.
Газ, который полностью подчиняется уравнению состояния идеального газа, называется идеальный газ. Такой газ не существует в действительности. Реальные газы хорошо подчиняются уравнению состояния идеального газа при низких давлениях и высоких температурах. Отклонения в поведении реальных газов от предписываемш уравнением состояния идеального газа подробно обсуждаются ниже.
Вычисление относительной молекулярной массы с помощью уравнения состояние идеального газа. Уравнение состояния идеального газа позволяет проводить прямые вычисления относительной молекулярной массы газа M1. Введем понятие относительной молекулярной массы, основываясь на уже знакомом нам (из гл. 1) определении относительной атомной массы A1. Для газа, состоящего из простых молекул, относительная молекулярная масса представляет собой сумму относительных атомных масс всех атомов, входящих в молекулу. Например, для диоксида углерода
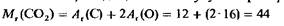
Относительная молекулярная масса, выраженная в граммах на моль, называется молярной массой (см. гл. 4). Следовательно, молярная масса CO2 равна 44 г/моль. Два моля CO2 имеют массу 88 г, а и молей-массу п -44 г. В общем случае можно записать
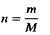
где n-количество вещества в молях (т.е. число молей данного вещества), т-масса вещества в граммах, a M-его молярная масса.
Подстановка полученного выражения для п в уравнение состояния идеального газа (4) дает
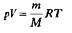 (5)
(5)
Это уравнение позволяет, зная массу и объем газа при определенных температуре и давлении, вычислить его молярную массу М. А поскольку
M = M (г/моль), то полученный результат непосредственно дает относительную молекулярную массу М.
13!P=2/3nEk
Ek=3/2KT
P=2/3n3/2KT
P=nKT
n=N/V
P=N/VKT
PV=V NaKT
PV=m/MRT
Дата добавления: 2015-01-19; просмотров: 359; Мы поможем в написании вашей работы!; Нарушение авторских прав |