
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изобарный процесс
Параметры состояния идеального газа на изобаре связаны соотноше-нием (1.9.7):

Отсюда видно, что чем выше температура газа, тем больше его объем. При этом величина объема на изобаре при повышении температуры растет тем быстрее, чем меньше давление.
Для реальных газов, жидкостей и твердых тел при нагревании также увеличивается объем на изобаре, (за исключением аномальных областей состояний четырех веществ: лед, германий, висмут, сурьма). Для характеристики термического расширения вещества при его изобарном нагревании вводят в рассмотрение коэффициент объемного расширения
 . (2.7.5)
. (2.7.5)
Как видно из формулы (2.7.5), коэффициент 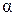 численно равен увеличению объема вещества, взятого в количестве
численно равен увеличению объема вещества, взятого в количестве  , при его изобарном нагревании на 1К. В частности, используя уравнение
, при его изобарном нагревании на 1К. В частности, используя уравнение 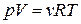 нетрудно получить, что для идеального газа коэффициент
нетрудно получить, что для идеального газа коэффициент 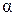 равен:
равен:
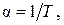 (2.7.6)
(2.7.6)
т. е. приращение объема идеального газа при его изобарном нагревании уменьшается с ростом температуры.
Известно, что коэффициент 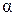 для газов, значительно больше, чем для жидкостей и твердых тел.
для газов, значительно больше, чем для жидкостей и твердых тел.
Работа системы в изобарном процессе равна
 (2.7.7)
(2.7.7)
Для идеального газа последнее выражение, очевидно, может быть пере-писано еще в одном виде:
 . (2.7.8)
. (2.7.8)
Количество теплоты, получаемое системой при нагревании (или отдаваемое системой при охлаждении) в изобарном процессе может быть найдено из первого закона термодинамики:
 (2.7.9)
(2.7.9)
где  – энтальпия или тепловая функция. Энтальпия является функцией состояния, так как
– энтальпия или тепловая функция. Энтальпия является функцией состояния, так как  и
и 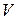 – функции состояния. Измеряется энтальпия в джоулях.
– функции состояния. Измеряется энтальпия в джоулях.
Интегрируя выражение  от состояния
от состояния  до состояния
до состояния  , получим
, получим
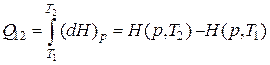 . (2.7.10)
. (2.7.10)
Таким образом, количество теплоты, получаемое системой при ее изобарном нагревании от состояния  до состояния
до состояния  , равно разности энтальпий в этих состояниях.
, равно разности энтальпий в этих состояниях.
Рассматривая энтальпию как функцию T и p, т. е.  мо-жем записать
мо-жем записать
 . (2.7.11)
. (2.7.11)
Откуда следует, что
 . (2.7.12)
. (2.7.12)
В определение теплоемкости вещества при постоянном давлении

вместо  подставим его выражение из (2.7.9). В результате будем иметь
подставим его выражение из (2.7.9). В результате будем иметь
 . (2.7.13)
. (2.7.13)
Из соотношений (2.7.13) и (3.7.12) следует, что
 . (2.7.14)
. (2.7.14)
Отсюда видно, что теплоемкость  характеризует скорость роста энтальпии Н при повышении температуры Т.
характеризует скорость роста энтальпии Н при повышении температуры Т.
Проинтегрируем (2.7.12) от состояния  до состояния
до состояния  .
.
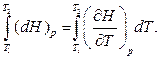 (2.7.15)
(2.7.15)
Учитывая выражения (2.7.10) и (2.7.14), последнее равенство можно переписать в виде
 (2.7.16)
(2.7.16)
Если теплоемкость  не зависит от температуры, то количество теплоты в изобарном процессе
не зависит от температуры, то количество теплоты в изобарном процессе
 (2.7.17)
(2.7.17)
Заметим, что энтальпия для идеального газа
 (2.7.18)
(2.7.18)
и, таким образом, не зависит от давления, так же как и внутренняя энергия 
Дата добавления: 2015-04-18; просмотров: 382; Мы поможем в написании вашей работы!; Нарушение авторских прав |