
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергетическая диаграмма возможных состоянийэлектрона в атоме водорода.
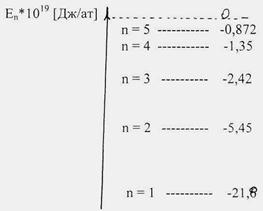
По данной диаграмме можно сделать след выводы:
По данной диаграмме можно сделать следующие выводы:
Энергия электрона в атоме может иметь не любые, а только определенные,
дискретные значения, то есть энергия электрона в атоме «квантована».
С увеличением главного квантового числа -п- увеличивается энергия
атомной орбитали и соответствующего энергетического уровня.
С увеличением главного квантового числа — п — разница в энергиях
соседних уровней уменьшается, то есть « уровни сближаются».
Устойчивым является состояние с минимальной энергией (п=1), его
называют основным. В основном состоянии атом не поглощает и не излучает
энергию и может находиться бесконечно долго.
Возбужденным называют состояние атома, в котором его энергия больше
минимально возможной. Возбужденное состояние не устойчиво.
 | 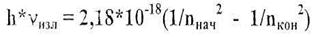 | ||
Переход атома из основного состояния в возбужденное, то есть электрона с
нижележащего на вышележащий подуровень, возможен только в результате
поглощения энергии. И, наоборот, при переходе атома из возбужденного
состояния в основное; то есть электрона с вышележащего на нижележащий
подуровень, энергия излучается. Причем, энергия излучения равна разности энергий соответствующих подуровней.
Дата добавления: 2015-04-18; просмотров: 308; Мы поможем в написании вашей работы!; Нарушение авторских прав |