
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
БИЛЕТ № 7
Химические свойства этиленовых углеводородов (УВ).
ОТВЕТ.
Химические свойства объясняются наличием π-связи, которая легко разрывается, вызывая реакции присоединения и окисления.
I. Реакции присоединения.
Присоединяться могут Н2, НГал, Гал2, Н2О.
СН2 =СН2 + Н2 → С2Н6; С2Н4 + НBr → С2Н5Br ;
С2Н4 + Cl2 → С2Н5Cl ; С2Н4 + Н2О → С2Н5ОН.
При присоединении несимметричных реагентов (Нгал, НОН) к несимметричным алкенам (т.е. с более длинной цепью углеродной) действует правило Марковникова:

 Водород присоединяется по разрыву π-связи к более гидрогенезированному атому углерода (т.е. там где больше водородов), а другая частица к углероду где меньше водородов.
Водород присоединяется по разрыву π-связи к более гидрогенезированному атому углерода (т.е. там где больше водородов), а другая частица к углероду где меньше водородов.
СН2 = СН – СН3 + НBr → СН3 – СН – СН3
Br
К реакциям присоединения относятся реакции полимеризации:
n СН2 =СН2 → n – СН2 – СН2 – → (– СН2 – СН2 –)n
этилен полиэтилен
II. Реакции окисления.
- алкены горят светящимся пламенем
CnH2n + 1,5nO2 → nCO2 + nH2O – общая формула горения непредельных.
С2Н4 + 3О2 → 2CO2 + 2 H2O
- алкены обесцвечивают раствор KМnO4 образуя спирты.
СН2 =СН2 + [О] + H2O → СН2 – СН2
ОН ОН
Этиленгликоль
Типы химических связей ( ковалентная, ковалентно-полярная, ионная). Способы разрыва химической связей.
ОТВЕТ.
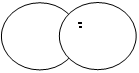
Ковалентная связь образуется в результате обобществления электронных пар. Это обобществления происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют два электронных облака, на которых в сумме находятся два электрона. Можно показать на примере молекулы водорода:


 |  |


 + →
+ →
схему этой связи можно показать по-другому: Н∙ + ∙ Н = Н :Н .
Ковалентная неполярная – образуется между атомами неметаллов одного вида – это простые вещества О2, Н2, Cl2, Br2, N2 …
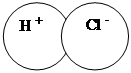
Ковалентно- полярная – образуется между атомами неметаллов разных по электроотрицательности . например H +Cl - , S +4O2 –2

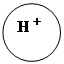 Схема этой связи:
Схема этой связи:
 |
+ →
∙∙
или эту схему можнол показать так: H ∙ + Cl ∙ → Н δ+ : Cl :δ-
∙∙
Во всех УВ органических веществ между атомами углерода и водорода ковалентно-полярная связь.
Ионная связь обычно имеют соли ( в органических соединениях спирты , карбоновые кислоты, соли карбоновых кислот).
Ионная связь возникает между ионами в веществах которые способны диссоциировать (распадаться или растворяться в воде) на ионы. Это результат отдачи и принятия электронов. Положительный ион переходит к отрицательному на его орбиталь. Пример : ∙∙ ∙∙
Na∙ + ∙Cl : =Na+ :Cl :−
∙∙ ∙∙
в результате образуются противоположено заряженные ионы, которые притягиваются. Эти вещества не имеют молекул, они представляют собой ионные кристаллические вещества, например, соли карбоновых кислот, алкоголяты щелочных металлав, гидрохлориды аминов.
[СН3- СН2 – СОО] − Na+ [СН3 – СН2 – О]− Na+ [ С6Н5 – NH3 ] + CL -
Дата добавления: 2015-04-21; просмотров: 286; Мы поможем в написании вашей работы!; Нарушение авторских прав |