
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Основные формулы. Количество вещества тела (системы):
Количество вещества тела (системы):

где N – число структур элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему);
NA – постоянная Авогадро (NA = 6.02 *1023 моль-1).
Молярная масса вещества:
M = m/ 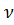
где m – масса однородного тела (системы);
 – количество вещества этого тела.
– количество вещества этого тела.
Уравнение Менделеева – Клапейрона ( уравнение состояния идеального газа):

где m – масса газ;
М – молярная масса газа;
R – молярная газовая постоянная;
V – объем газа;
Т – термодинамическая температура.
Объединенный газовый закон (m = const):
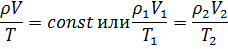
где ρ1, V1, T1 – давление, объем и температура газа в начальном состоянии;
ρ2, V2, T2 – те же величины в конечном состоянии.
Концентрация молекул:
n = N/V
где N – число молекул, содержащихся в данной системе;
 – плотность вещества;
– плотность вещества;
V – объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение кинетической теории газов:
ρ=3/2 n<εn>
где <εn> - средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы:
<εn> = 3/2 kТ
где k – постоянная Больцмана.
Средняя полная кинетическая энергия молекулы:
<εn> = i/2 kТ
где i – число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры:
p = nkT.
Скорости молекул:
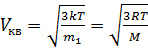 - средняя квадратичная
- средняя квадратичная
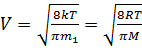 – средняя арифметическая
– средняя арифметическая
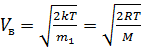 - наиболее вероятная
- наиболее вероятная
где m1 - масса одной молекулы.
Удельные теплоемкости газа при постоянном объеме (Сv) и постоянном давлении (Cp):
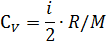

Связь между удельной с и молярной C теплоемкостями:
с = С/M
С = сМ
Уравнение Майера:
Сp + Cv = R
Внутренняя энергия газа:
U = i/2RT(m/M) = m/M 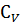 T
T
Первое начало термодинамики:
Q = △U+A
где Q – теплота, сообщенная системе (газу);
△U – изменение внутренней энергии системы;
A – работа, совершенная системой против внешних сил.
Работа расширения газа:
А = 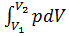 в общем случае
в общем случае
А = p(  при изобарном процессе
при изобарном процессе
А = m/ 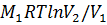 при изотермическом процессе
при изотермическом процессе
A = - △U = - m/M 
при адиабатном процессе, где γ = 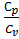 - показатель адиабаты.
- показатель адиабаты.
Уравнение Пуассона, связывающее параметры идеального газа при адиабатном процессе:
 γ-1
γ-1
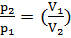 γ ,
γ , 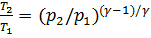
Термический КПД цикла:
η = 
где 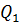 - теплота, полученная рабочим телом от теплоотдатчика;
- теплота, полученная рабочим телом от теплоотдатчика;
 – теплота, переданная рабочим телом теплоприемнику.
– теплота, переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно:
η = 
где  – термодинамические температуры теплоотдатчика и теплоприемника.
– термодинамические температуры теплоотдатчика и теплоприемника.
Коэффициент поверхностного натяжения:
α = F/l или α = △Е/△S
где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости;
△E – изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади △S поверхности этой пленки.
Дата добавления: 2015-02-09; просмотров: 268; Мы поможем в написании вашей работы!; Нарушение авторских прав |