
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакция с оксалатом аммония (фармакопейная).
Са2+ + С2О42- → СаС2О4 ↓ (белый кристаллический)
Осадок нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты.
3. Реакция с углекислым натрием (Na2CO3).
Са2+ + Na2CO3 = CaCO3 ↓ (белый) + NH4+
Осадок СаСО3 легко растворяется в минеральных и уксусной кислотах.
4. Реакция с гексацианоферратом (II) калия.
Ca2+ + 2 NH4+ + [Fe (CN)6]4- = (NH4)2Ca[Fe(CN)6]↓
Выпадает белый кристаллический осадок, который не растворяется в уксусной кислоте
5.Реакция с гидрофосфатом натрия (Na2HPO4).
Са2+ + НРО42- = СаНРО4 ↓ (белый).
6. Реакция с родизонатом натрия.
Na2C6O6 + 2 Ca2+ + 2 OH- → Ca2С6O6(OH)2 + 2 Na+. (фиолетовый, растворим в HCl)
7*. Окрашивание пламени (фармакопейный тест).
Соли и другие соединения кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
Качественные реакции катионов Sr2+
1. Реакция с серной кислотой и растворимыми сульфатами.
Sr2+ + SO42- = SrSO4 ↓ (белый кристаллический)
а). Реакция с «гипсовой водой». Выделяется белый осадок SrSO4.
б). Реакция с серной кислотой (Н2SO4). Выпадает белый кристаллический осадок SrSO4., который нерастворим в щелочах, в растворе сульфата аммония (в отличие от сульфата кальция).Мешают катионы Ва2+.
2. Реакция с карбонат - ионами.
Sr2+ + CO32- = SrCO3 ↓ (белый кристаллический), растворимый в кислотах.
3. Реакция с оксалатом аммония.
Sr2+ + C2O42- = SrC2O4 ↓ (белый)
Осадок частично растворяется в уксусной кислоте.
4. Реакция с гидрофосфатом натрия (Na2HРО4).
Sr2+ + HPO42- = SrHPO4 ↓ (белый)
Осадок растворяется в минеральных и уксусной кислотах.
5. Реакция с родизонатом натрия.
Sr2+ + Na2C6O6 = SrC6O6 (красно-бурый, растворим в HCl)+ 2 Na+
Образование красно-бурого пятна. В растворе HCl окраска пятна исчезает.
6. Окрашивание пламени газовой горелки.
Соли стронция при внесении в бесцветное пламя горелки окрашивают пламя в карминово-красный цвет.
Качественные реакции катионов Ва2+
1*. Реакция с серной кислотой и растворимыми сульфатами.
Ва2+ + SO42- = BaSO4 ↓ (белый мелкокристаллический)
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной H2SO4, в которой он заметно растворяется с образованием гидросульфата бария:
BaSO4 + H2SO4 → Ba(HSO4)2.
При нагревании с раствором карбонатов (Na2CO3) сульфат бария превращается в мало растворимый в Н2О карбонат бария ВаСО3, который растворяется в кислотах. Мешают проведению реакции Са2+, Sr2+, Pb2+.
2. Реакции с углекислым натрием, гидрофосфатом натрия и оксалатом
аммония (Na2CO3, Na2HPO4, (NH4)2C2O4). Выпадают белые осадки, растворимые в соляной, азотной и уксусной кислотах (ВаС2О4 - при нагревании).
3. Реакция с родизонатом натрия.
в нейтр. среде: Ва2+ + Na2C6O6 = BaC6O6 ↓ + 2 Na+ (красно-бур.)
в кисл. среде: Ва2+ + 2 Na2C6O6 + 2 Н+ = Ba(НC6O6)2 ↓ + 4 Na+ (ярко красн.)
4. Реакция с хроматом и дихроматом калия.
Ва2+ + СrO42- = BaCrO4 ↓ (желтый кристаллический)
2 Ba2+ + Cr2O72- + 2 CH3COO- + HOH = 2 BaCrO4 + 2 CH3COOH
Растворяется в сильн. кислотах (кроме H2SO4), не растворяется в уксусной кислоте.
5*. Окрашивание пламени горелки.
Соли и другие соединения бария окрашивают бесцветное пламя горелки в желто-зеленый цвет.
Аналитические реакции катионов IV аналитической группы по кислотно-основной классификации: Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+.
Групповой реагент – гидроксид натрия или калия в присутствии Н2О2
Аналитические реакции катиона цинка Zn2+.
1. Реакция с щелочами: Zn2+ + 2 OH- → Zn(OH)2 ↓ (белый)
Zn(OH)2 + 2 OH- → [Zn(OH)4]2- (бесцветный)
2. Реакция с раствором аммиака: Zn2+ + 2 NH3×H2O → Zn(OH)2 ↓ (белый) + 2 NH4+
Zn(OH)2 + 4 NH3 → [Zn(NH3)4] (OH)2 (бесцветный)
3. Реакция с сульфид – ионами (фармакопейная): Zn2+ + S2- → ZnS ↓ (белый)
Реакцию часто проводят в уксуснокислой среде.
4. Реакция с гексацианоферратом (II) калия (фармакопейная).
Реакцию проводят в нейтральной или слабокислой среде, при нагревании.
2 К+ + 3 Zn2+ +2 [Fe(CN)6]4- → K2Zn3 [Fe(CN)6]2↓ (белый)
Осадок нерастворим в разбавленной HCl, растворяется в щелочах.
5. Реакция с дитизоном (дифенилтиокарбазоном). В растворах дитизона устанавливается таутомерное равновесие между тионной и тиольной формами:
N = N – C6H5 N = N – C6H5
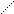
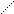
 S = C <=> Н-S
S = C <=> Н-S


NH – NH – C6H5 N – NH – C6H5
тионная форма тиольная форма
В результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:

 N = N - C6H5 C6H5 – HN – N = C – N = N - C6H5
N = N - C6H5 C6H5 – HN – N = C – N = N - C6H5


 2HS – C + Zn2+ ↔ ↓
2HS – C + Zn2+ ↔ ↓
 N – NH - C6H5 S - Zn - S +2 Н+
N – NH - C6H5 S - Zn - S +2 Н+
↑
C6H5 – N = N – C = N – NH - C6H5 (красный)
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекуле воды.
6. Реакция образования «зелени Ринмана».
Zn(NO3)2 + Co(NO3)2 —t↑→ CoZnO2 (зеленый) + 4 NO2 +O2.
«Зелень Ринмана» - смешанный оксид кобальта и цинка CoZnO2 зеленого цвета.
Другие реакции катионов цинка.
Катионы Zn2+ при взаимодействии с различными другими реактивами образуют осадки: с Na2HPO4 – белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке); с K2CrO4 – желтый ZnCrO4 (растворяется в кислотах и щелочах); с CoCl2 и (NH4)2[Hg (SCN)4] – голубой ZnCo[Hg (SCN)4]; а также с различными орг. реагентами.
Аналитические реакции катиона алюминия Al3+.
1. Реакция с щелочами: Al3+ + 3 OH- → Al(OH)3 ↓ (белый)
Al(OH)3 + 3 OH- → [Al(OH)6]3-
После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4Cl). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок Al(OH)3:
[Al(OH)6]3- + 3 NH4+ → Al(OH)3 + 3 NH3 + 3 H2O
Наиболее полное осаждение гидроксида алюминия происходит при рН~ 5-6.
Осадок Al(OH)3 растворяется в кислотах, но не растворяется в аммиаке.
2. Реакция с аммиаком.
Al3+ + 3 NH3×H2O → Al(OH)3 ↓ (белый аморфный) + 3 NH4+
3. Реакция с нитратом кобальта – образование «тенаровой сини» (фармакопейная).
«Тенаровая синь» - смешанный оксид алюминия и кобальта синего цвета.
2 Al2(SO4)3 + 2 Co(NO3)2 —t↑→ 2 Cо(AlO2)2 + 4 NO2 + 6 SO3 + O2.
4. Реакция с алюминоном.
Катионы Al3+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для краткости NH4L) образует в уксуснокис-лой или аммиачной среде комплекс красного цвета (по-видимому, состава Al(OH)2L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок.
Мешают катионы Са2+, Сr3+, Fe3+, также образующие окрашенные комплексы
с алюминоном.
Дата добавления: 2015-04-15; просмотров: 1730; Мы поможем в написании вашей работы!; Нарушение авторских прав |