
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Групповой реагент – NH4OH в избытке.
Хотя элементы расположены в разных группах периодической системы Д.И.Менделеева, все эти катионы характеризуются способностью к комплексообразованию. Их гидроксиды растворяются в избытке аммиака с образованием комплексов различного состава. Растворы солей меди, кобальта и никеля окрашены; кадмия и ртути (II) бесцветны.
Аналитические реакции катиона меди (II) Cu2+.
Акво – ионы меди (II) [Cu(H2O)n]2+ окрашены в голубой цвет, поэтому растворы солей меди (II) имеют голубую окраску с разными оттенками (от голубой до сине-зеленой). В водных растворах акво - ионы меди (II)
частично гидролизуются с образованием растворимых гидроксо-аквокомплексов состава [Cu(H2O)n-m(OH)m]2-m по схеме:
[Cu(H2O)n]2+ + mH2O = [Cu(H2O)n-m(OH)m]2-m + mH3O+
1. Реакция с щелочами.
Cu2+ + 2 OH- → Cu(OH)2 ↓(сине-зеленый)
Смесь осторожно нагревают до кипения и кипятят до потемнения осадка. Cu(OH)2 разлагается, теряя воду и образуется черный осадок оксида меди (II) CuO: Cu(OH)2 → CuO ↓(черный) + Н2О
Осадок Cu(OH)2 растворяется в кислотах, в растворах аммиака (с образованием комплекса [Cu(NH3)4]2+ синего цвета), комплексообразующих органических кислот (лимонная, винная), частично растворим в концентрированных щелочах с образованием гидроксокомплексов меди (II).
2. Реакция с аммиаком (фармакопейная).
CuCl2 + NH3×H2O → Cu(OH)Cl ↓(сине-зеленый)
В избытке аммиака осадок растворяется с образованием ярко синего раствора:
Cu(OH)Cl + 4 NH3×H2O → [Cu(NH3)4]2+ + OH- + Cl- + 4 H2O
В кислой среде комплексный тетрамминмедь (II) – катион разрушается:
[Cu(NH3)4]2+ (ярко - синий) + 4 H3O+ → [Cu(Н2О)4]2+ (голубой) + 4 NH4+
и окраска раствора из ярко-синей переходит в голубую (цвет аквокомплекса меди (II)). К аммиачному комплексу меди (II) прибавляют по каплям разбавленный раствор одной из кислот – HCl, HNO3 или Н2SO4.
Окраска раствора из ярко - синей переходит в голубую.
Мешают катионы Cо2+, Ni2+, олово (II).
3. Реакция с гексацианоферратом (II) калия.
2Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6]↓(красно-коричневый).
Капельный метод на фильтровальной бумаге: на лист фильтровальной бумаги, пропитанной раствором ферроцианида калия, наносят каплю раствора соли меди (II). На бумаге образуется красно-коричневое пятно.
Осадок не растворяется в разбавленных кислотах, но растворяется в 25%-м водном аммиаке:
Cu2[Fe(CN)6] + 12 NH3+ 4 H2O → ( NH4)4[Fe(CN)6] + 2 [Cu(NH3)4](ОН)2
Проведению реакции мешают катионы, также образующие окрашенные осадки ферроцианидов (Fe3+, Co2+, Ni2+).
4. Реакция с тиосульфатом натрия.
2Cu2+ + 2 S2O32-(избыток) + 2 H2O → Cu2S ↓(темно-бурый) + S↓ +4 H+ + 2SO42- Выпадает темный осадок, содержащий смесь Cu2S и S.
5. Реакция с купроном (1-бензоиноксимом).
С6Н5 – СН - ОН | купрон (H2L) левее меди.
Cu2+ + Zn → Cu + Zn2+
Cu2+ + Fe → Cu + Fe2+
3 Cu2+ +2 Al → 3 Cu +2 Al3+
7. Соли меди окрашивают пламя газовой горелки в изумрудно-зеленый цвет.
8. Реакция с тиоцианат – ионами.
Cu2+ + 2 SCN- → Cu(SCN)2↓→ CuSCN↓ + SCN-
Образуется черный осадок Cu(SCN)2, постепенно переходящий в белый CuSCN.
9. Другие реакции меди (II).
Катионы Cu2+ с сульфид -ионами дают черный осадок сульфида меди CuS; с фосфатами – голубой осадок Cu3(PO4)2. Известны реакции комплексообразования меди (II) с различными органическими реагентами – купроином, купфероном, дитиоксамидом и др.
Аналитические реакции катиона кадмия Cd2+.
Акво – ионы кадмия [Cd(H2O)n]2+ в водных растворах бесцветны.
1. Реакция с щелочами и аммиаком.
Cd2+ + 2 OH- → Cd(OH)2↓(белый)
Осадок Cd(OH)2 нерастворим в избытке щелочи, но растворяется в избытке аммиака с образованием бесцветного аммиачного комплекса [Cd(NH3)4]2+:
Cd(OH)2 + 4 NH3 → [Cd(NH3)4]2+ + 2 OH-
Осадок Cd(OH)2 растворяется в кислотах:
Cd(OH)2 + 2 H3О+ → [Cd(H2О)4]2+
2. Реакция с сульфид – ионами.
Cd2+ + S2- → CdS↓(желтый)
Осадок CdS не растворим в щелочах и в растворе сульфида натрия, частично растворяется в насыщенном растворе хлорида натрия с образованием хлоридного комплекса кадмия [CdCl4]2-:
CdS + 4 Cl- → [CdCl4]2- + S2-
CdS нерастворим в кислотах, за исключением HCl, в которой он растворяется с образованием хлоридного комплекса кадмия:
CdS + HCl → H2[CdCl4] +H2S
3. Реакция с тетраиодовисмутатом (III) калия.
Cd2+ + 2 [BiI4]- → CdI2 + 3BiI3 ↓(черный)
4. Реакция с тетрароданомеркуратом (II) аммония.
Cd2+ + [Hg(SCN)4]2- → Cd[Hg(SCN)4]
Образование бесцветных продолговатых кристаллов тетрароданомеркурата кадмия Cd[Hg(SCN)4].
5. Другие реакции кадмия Cd2+.
Cd2+ реагирует с комплексоорганическими реагентами:
дитизоном, кадионом, β-нафтохинолином, меркаптобензимидазолом, меркаптобензтиазолом и т.д.
Аналитические реакции катиона кобальта (II) Cо2+.
Акво – ионы кобальта (II) октаэдрической структуры [Cо(H2О)6]2+ окрашены в розовый цвет, поэтому разбавленные водные растворы солей кобальта (II) также имеют розовую окраску. Однако при выпаривании водных растворов Cо2+ их окраска меняется на синюю, характерную для комплексов кобальта (II) тетраэдрической структуры. Соединения Со(II) легко окисляется до соединений Со (III), причем в ряде случаев – уже кислородом воздуха (растворенным в воде), что необходимо учитывать при проведении качественных реакций на кобальт (II). В водных растворах кобальт (II) и кобальт (III) присутствуют исключительно в форме комплексных соединений. Комплексы Со(III) устойчивее комплексов Со (II).
1. Реакция с щелочами.
CоCl2 + OH- → CoOHCl↓(синий) + Cl-
CoOHCl + OH- → Co(OH)2↓(розовый) + Cl-
2 Co(OH)2 + 0,5 О2 + Н2О → 2 Co(OH)3↓(черно-бурый)
Если к розовому осадку Со(ОН)2 прибавить Н2О2, то реакция окисления Со(ОН)2 в черно-бурый Co(OH)3 протекает практически мгновенно:
2 Co(OH)2 + Н2О2 → 2 Co(OH)3.
Действие смеси Н2О2 со щелочью на раствор соли кобальта (II) сразу приводит к образованию черно-бурого осадка Co(OH)3:
2 CоCl2 + 4 OH- + Н2О2 → 2 Co(OH)3 + 4 Сl-
2. Реакция с аммиаком.
CоCl2 + NH3*H2O → CoOHCl↓(синий) + NH4Cl
CoOHCl + 5 NH3 + NH4Cl → [Co(NH3)6]Cl2 (желтый) + H2O
При стоянии на воздухе, раствор постепенно меняет окраску на вишнево – красную, за счет окисления кобальта (II) до кобальта (III) с образованием хлоропентамминкобальт (III) – анионов [Co(NH3)5Сl]2- вишнево – красного цвета:
2 [Co(NH3)6]Cl2 + O2 + 2 H2O → 2 [Co(NH3)5Сl](OH)2 + 2 NH3
В присутствии Н2О2 и солей аммония реакция окисления [Co(NH3)6]2+ до [Co(NH3)5Сl]2+ протекает практически мгновенно:
2 [Co(NH3)6]Cl2 + 2 H2O2 + 2 NH4Cl → 2 [Co(NH3)5Сl]Cl2 +4 NH3 + 2 H2O
3. Реакция с тетратиоцианатомеркуратом (II) аммония (тетрароданомеркуратом (II) аммония).
Cо2+ + [Hg(SCN)4]2- → Cо[Hg(SCN)4]↓(темно-синие кристаллы)
Из разбавленных растворов кристаллы выделяются медленно.
Выпадает голубой осадок смешанного тиоцианатного комплекса цинка и кобальта (II):
XZn2+ + Yco2+ + (X+Y) [Hg(SCN)4]2- → ZnxCoy[Hg(SCN)4]x+y
Прибавление даже небольших количеств соли цинка приводит к почти полному осаждению кобальта (II).
Проведению реакции мешают катионы Cd2+, Cu2+, Fe3+, Ni2+.
4. Реакция с тиоцианат – ионами.
Co2+ + 4 NCS- ↔ [Co(NСS)4]2+ (синий)
Реакцию проводят в слабо кислой среде.
Комплекс в водных растворах неустойчив и равновесие комплексообразования смещено влево в сторону образования розового аквокомплекса кобальта (II). Поэтому реакцию проводят при избытке тиоцианат – ионов, чтобы сместить равновесие вправо. Равновесие смещается вправо также в водно – ацетоновых растворах, в силу чего реакцию иногда проводят в водно – ацетоновой среде (ацетон хорошо смешивается с водой).
В растворах органических растворителей (изоамиловый спирт, эфир) устойчивость комплекса повышается, поэтому при проведении данной реакции водный раствор, содержащий катионы Co2+, смешивают с небольшим количеством органического растворителя (смесь изоамилового спирта и диэтилового эфира). При этом [Co(NCS)4]2+ переходит в органическую фазу и окрашивает ее в синий цвет.
Проведению реакции мешают катионы Fe3+, Сu2+, также образующие окрашенные соединения с тиоцианат – ионами – желто-бурый комплекс меди (II) и красные комплексы железа (III). Мешающее действие катионов Fe3+ устраняют связывая их в устойчивые бесцветные комплексы такими маскирующими агентами, как фторид – и тартрат –анионы, прибавляя NaF и NaKC4H4O6 соответственно.
5. Реакция с сульфид – ионами.
Со2+ + S2- → CoS ↓(черный)
Осадок CoS растворяется в минеральных кислотах.
6. Реакция с солями цинка – образование «зелени Ринмана».
Zn(NO3)2 + Co(NO3)2 → CoZnO2 + 4 NO2 + O2
Образуется зола зеленого цвета.
7. Реакция с реактивом Ильинского (1-нитрозо-2-нафтол) - проводят в нейтральной или слабо кислой среде. 1-нитрозо-2-нафтол в растворе может существовать в двух таутомерных формах, условно обозначаемых через HL:


 NO N - OH
NO N - OH
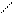


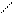

 ОН O
ОН O



(HL)
В этой реакции вначале кобальт (II) окисляется до кобальт (III), который с 1-нитрозо-2-нафтолом образует внутрикомплексное соединение, выделяющееся в виде пурпурно-красного осадка:
Со3+ + 3 HL → CoL3 + 3 H+
8. Реакция с нитрозо- R- солью (фармакопейная).
Нитрозо – R – соль можно представить в двух таутомерных формах:
NO N - OH








 OH O
OH O
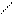





 (HL1)
(HL1)
НО3S SO3H HO3S SO3H
Реакцию проводят в кислой среде при нагревании.
В кислой среде кобальт (II) окисляется до кобальта (III), а последний взаимодействует с HL1 и образует внутрикомплексное соединение состава СоL31:
Со3+ + 3 HL1 = CoL31↓ (красный) + 3 Н+
9. Другие реакции катионов кобальта (II).
Катионы кобальта Со2+ с нитритом калия KNO2 в уксуснокислой среде образуют (после окисления до Со3+) желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO2)6]; по этой реакции катионы кобальта можно открыть в присутствии катионов никеля.
Соединение Со2+ с бурой Na2B4O7*10H2O образуют перлы синего цвета, с рубеановодородной кислотой NH2CSCSNH2 – желто-бурый осадок комплексного соединения.
Аналитические реакции катиона никеля (II) Ni2+.
Аквокомплексы никеля (II)[Ni(H2O)6]2+ окрашены в зеленый цвет, поэтому водные растворы солей никеля (II) имеют зеленую окраску. В растворе никель (II) присутствует только в форме комплексных соединений.
1. Реакция с щелочами.
Ni2+ + 2 OH- → Ni(OH)2↓(зеленый)
Проба на растворимость. Осадок Ni(OH)2 растворяется в растворах кислот и аммиака: Ni(OH)2 + 2 Н+ → Ni2+ + 2 H2О
Ni(OH)2 +6 NH3 → [Ni(NH3)6]2+ + 3 OH-
2. Реакция с аммиаком.
Ni(NO3)2 + NH3*H2O → NiOHNO3 + NH4NO3,
NiCl2 + NH3*H2O → NiOHCl + NH4Cl
2NiSO4 + 2 NH3*H2O → Ni(OH)2SO4 + (NH4)SO4,
Методика. В пробирку вносят 2-3 капли раствора соли хлорида никеля (II) Добавляют конц. (25%-й) раствор аммиака до полного растворения осадка и образования раствора синего цвета:
NiOHCl + 6 NH3 → [Ni(NH3)6]2+ + OH- + Cl-
Оксисоль Ni(II) гексамминникель (II) катион
Прибавляют к ней по каплям концентрированный раствор KBr до выпадения фиолетового осадка [Ni(NH3)6]Br2.Комплексы [Ni(NH3)6]Cl2, [Ni(NH3)6](NO2)2, [Ni(NH3)6]SO4 хорошо растворяются в воде, а остальные мало растворимы в воде.
3. Реакция с реактивом Чугаева (диметилглиоксимом).
O …… H-O
 |  |



 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3
 Ni2++ → Ni + 2 Н+, при рН≈6-9
Ni2++ → Ni + 2 Н+, при рН≈6-9

 Н3С-С=N-OH Н3С-С=N N=C-CH3
Н3С-С=N-OH Н3С-С=N N=C-CH3


О-Н…….. О
Розово-красный Бис-диметилглиоксиматоникель (II)
Реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Проведению реакции мешают катионы Cu2+, Pb2+, Fe2+, Fe3+.
Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих Ni (II) в Ni (III), комплекс которого имеет еще более интенсивную окраску.
4. Реакция с сульфид - ионами.
Ni2+ + S2- → NiS↓ (черный)
5. Другие реакции катионов Ni (II).
Катионы Ni2+ с тиоцианатом калия KNCS и пиридином (Py) образуют голубой осадок комплекса состава [NiPy](NCS)2; со смесью щелочи и хлорной воды – черно-бурый осадок гидроксида Ni (III) Ni(OH)3; с рубеановодородной кислотой –сине-фиолетовый осадок рубеаната никеля малорастворимый в кислотах и аммиаке.
Аналитические реакции катиона ртути (II) Hg2+.
Акво - ионы ртути (II) [Hg(H2O)n]2+ в водных растворах бесцветны. Все соединения ртути (II) сильно ядовиты, поэтому при работе с ними следует принимать меры предосторожности!
1. реакция с щелочами (фармакопейная).
Hg2+ + 2 OH- → HgO↓(желтый) + Н2О
Осадок HgO растворяется в азотной кислоте, в растворах хлоридов и иодидов щелочных металлов с образованием соответственно Hg(NO3)2, HgCl2 и комплекса [HgI4]2-:
HgO + 2 HNO3 → Hg(NO3)2 + H2O
HgO +2 Cl- + H2O → HgCl2 + 2 OH-
HgO +4 I- + H2O → [HgI4]2- + 2 OH-
2. Реакция с аммиаком.
HgCl2 + 2 NH3 → HgNH2Cl↓(белый) + NH4Cl
2 Hg(NO3)2 + 4 NH3 + H2O → [OНg2NH2]NO3↓(белый) + 3 NH4NO3
Осадки растворяются (лучше – при нагревании) в избытке аммиака; но только в присутствии солей аммония, с образованием бесцветного комплексного катиона тетрамминртути (II) [Нg(NH3)4]2+.
После выпадения осадков в пробирки добавляют по 3-4 капли водного раствора соли аммония (NH4Cl или NH4NO3) и по каплям – водный раствор аммиака при перемешивании до полного растворения осадков:
HgNH2Cl + 2 NH3 + NH4+ → [Нg(NH3)4]2+ + Cl-
[OНg2NH2]NO2 + 4 NH3 +3 NH4+ → 2 [Нg(NH3)4]2+ +NO3- + H2O
3. Реакция с иодидом калия (фармакопейная).
Hg2+ + 2 I- → HgI2↓(красный)
HgI2 + 2 I- → [HgI4]2- (бесцветный)
Проведению реакции мешают катионы Pb2+, Cu2+, Ag+, Bi(III), а также окислители. Капельный метод рекомендуется для открытия Hg2+ даже в присутствии мешающих катионов.
4. Реакция с сульфид - ионами (фармакопейная).
Реакция протекает в несколько стадий. Вначале образуется белый осадок, постепенно изменяющий окраску через желто – красную и бурую на коричнево-черную при избытке сульфид – ионов.
3 HgCl2 + 2 H2S → 2 HgS×HgCl2↓(белый) + 4 HСl
2 HgS×HgCl2 + H2S → 3 HgS↓(коричнево-черный) + 2 НСl
Дата добавления: 2015-04-15; просмотров: 2278; Мы поможем в написании вашей работы!; Нарушение авторских прав |