
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аналитические реакции борат – ионов В4О72- и ВО2-.
Тетраборат – ион В4О72- - анион слабой двухосновной тетраборной кислоты Н2В4О7, которая в свободном состоянии неизвестна, но может существовать в растворах. В водных растворах бесцветен, подвергается глубокому гидролизу.
Метаборат – ион ВО2- (борат – ион) - анион не существующей в растворах метаборной кислоты НВО2. Метаборат – ион в водных растворах бесцветен, подвергается гидролизу. Метаборат –ион как и тетраборат – ион не обладает окислительно – восстановительными свойствами, обладает умеренной комплексообразующей способностью как лиганд.
Применяемая на практике борная кислота – это трехосновная ортоборная кислота Н3ВО3(или В(ОН)3). Борная кислота хорошо растворяется в воде и в водных растворах, является очень слабой кислотой.
В водных растворах тетра -, орто- и метаборная кислоты находятся в равновесии:
Н2В4О7 + 5 Н2О ↔ 4Н3РО3 ↔ 4 НВО2 + 4 Н2О
Бораты аммония и щелочных металлов растворимы в Н2О. Бораты других металлов малорастворимы в воде. Из боратов наибольшее практическое значение имеет декагидрат тетрабората натрия Na2B4O7×10 H2O – белое кристаллическое вещество называемое бурой. Бура применяется в качественном анализе для открытия металлов по образованию окрашенных плавов – «перлов» буры, а также в количественном титриметрическом анализе как первичный стандарт.
1. Реакция с хлоридом бария.
В4О72- + Ва2+ + 3 Н2О → Ва(ВО2)2 + 2 Н3ВО3
Осадок растворяется в азотной и уксусной кислотах.
2. Окрашивание пламени горелки сложными эфирами борной кислоты (фармакопейный тест). Борат – ионы или борная кислота образуют с этанолом С2Н5ОН в присутствии Н2SО4 сложный этиловый эфир борной кислоты (С2Н5О)3В, который окрашивает пламя в зеленый цвет.
В4О72- + 2 Н+ + 5 Н2О = 4 Н3ВО3
Н3ВО3 + 3 С2Н5ОН = (С2Н5О)3В +3 Н2О
Пламя окрашивается в зеленый цвет.
3. Реакция с куркумином (фармакопейная).
Краситель куркумин (желтого цвета) в растворах может существовать в двух таутомерных формах – кетонной и енольной, находящихся в равновесии:


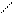 ОСН3 ОСН3
ОСН3 ОСН3


 О = С – СН =СН – ОН НО – С – СН = СН - ОН
О = С – СН =СН – ОН НО – С – СН = СН - ОН
| ||
СН2 ↔ СН
 | |
| |



 О = С – СН = СН ОН О = С – СН = СН - ОН
О = С – СН = СН ОН О = С – СН = СН - ОН
 | |||
 | |||
ОСН3 ОСН3
Кетонная форма енольная форма
Щелочные растворы куркумина имеют красно–коричневый цвет, кислые – светло–желтый.
Реакцию проводят обычно с помощью куркумовой бумаги. Ее готовят, пропитывая белую плотную фильтровальную бумагу спиртовым раствором куркумина и затем высушивая ее в защищенном от света месте в атмосфере, не содержащей паров кислот и аммиака.
4. Другие реакции борат – ионов.
В качественном анализе используют реакцию получения перлов буры: при плавлении буры образуется прозрачная стекловидная масса – «перлы буры». Если плавить смесь буры с солями металлов, то образуются окрашенные перлы, цвет которых зависит от природы катиона металла.
Дата добавления: 2015-04-15; просмотров: 1718; Мы поможем в написании вашей работы!; Нарушение авторских прав |