
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тартрат-, цитрат-, бензоат- и салицилат- ионов.
Группового реагента не имеется.
Аналитические реакции нитрит – иона NO2-.
Нитрит – ион – анион очень слабой одноосновной азотистой кислоты HNO2, которая в водных растворах при обычных температурах неустойчива и легко разлагается по схеме:
2 HNO2 ↔ N2O3 + H2O
N2O3 ↔ NO + NO2
В водных растворах гидролизуется; редокс – амфотерен. Нитриты хорошо растворяются в воде (нитрит серебра AgNO2 – при нагревании). Нитрит – ион образует комплексы со многими металлами. Некоторые из этих координационных соединений, в отличие от «простых» нитритов, мало растворимы в воде, например, гексанитрокобальтаты (III) калия К3[Со(NO2)6] и аммония (NH4)3[Со(NO2)6], что используют в качественном анализе. Нитриты токсичны!
1. Реакция с дифениламином (фармакопейная).
Реакцию проводят в концентрированной серной кислоте. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2С6Н5NHС6H5 → C6H5 – NH – C6H4 –C6H4 – NH – C6H5 + 2 H+ + 2ē
дифениламин дифенилбензидин (бесцветный)
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода. Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилдифенохинондиимина, при котором молекулы дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода:
 |  |  |  |  |
 –NH– – - NH– → C6H5 – N = = = N – C6H5 +2H+ +2ē
–NH– – - NH– → C6H5 – N = = = N – C6H5 +2H+ +2ē
Дифенилбензидин (бесцветный) дифенилдифенохинондиимин (синий)
При стоянии синей смеси, ее окраска постепенно изменяется вначале на бурую, а затем – на желтую, вследствие необратимого разрушения синего продукта реакции.
Проведению реакции мешают как анионы – окислители (ClO3-,Br3-.Cr2O72- и др.), так и анионы – восстановители (S2-, SO32-, S2O32-, I- и др.).
Нитрат – ион NO3- дает аналогичную реакцию с дифениламином.
2. Реакция с сильными кислотами (фармакопейная).
NO2- + H+ ↔ HNO2
2HNO2 → N2O3 + H2O → NO↑ + NO2↑ + H2O (желто-бурые пары)
3. Реакция с иодидом калия (нитрит – ион – окислитель).
Нитрит – ион в кислой среде (HCl, H2SO4, CH3COOH) окисляет иодид – ионы до свободного иода:
2 NO2- + 2 I- + 4 H+ → I2 + 2 NO + 2 H2O
Образующийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем – бензолом, хлороформом (органический слой окрашивается в фиолетовый цвет).
Нитрат - ион NO3- не мешает проведению реакции, поэтому ионы NO2- можно открыть в присутствии нитрат – ионов.
Проведению реакции мешают окислители (MnO4-.Cr2O72- и др.).
4. Реакция с перманганатом калия (нитрит – ион – восстановитель).
5 NO2- + 2 MnO4- + 6 H+ → 5 NO3- + 2 Mn2+ + 3 H2O
Проведению реакции мешают другие восстановители (S2-, SO32-, S2O32-, C2O42-, SCN-, AsO33-,I-, Br-), также реагирующие с MnO4- - ионами.
Нитрат – ион NO3- не обесцвечивает раствор KMnO4 (отличие от нитрит – иона – фармакопейный тест).
Розовый раствор перманганата калия обесцвечивается.
5. Реакция с реактивом Грисса – Илотвая.
Реактив Грисса – Илотвая – смесь сульфаниловой кислоты HSO3C6H4NH2 c 1- нафтиламином С10Р7NH2. Реакцию проводят в нейтральных или уксуснокислых растворах.Образующаяся в кислой среде в присутствии нитрит – иона азотистая кислота HNO2 реагирует с сульфаниловой кислотой, давая соль диазония:
 |  |

 HSO3- - - NH2 +HNO2 + CH3COOH→ HSO3 - --N+= N CH3COO- +2 H2O
HSO3- - - NH2 +HNO2 + CH3COOH→ HSO3 - --N+= N CH3COO- +2 H2O
Сульфаниловая кислота соль диазония
Соль диазония далее вступает в реакцию азосочетания с 1- нафтиламином, образуя продукт – азокраситель красного цвета:
 |  | ||||||||
 |  |  | |||||||


 HSO3 - -N+= N CH3COO- + →HSO3- - N=N- +СН3СООН
HSO3 - -N+= N CH3COO- + →HSO3- - N=N- +СН3СООН
H2N- Н2N-
Соль диазония 1-нафтиламин азокраситель (красный)
В результате раствор окрашивается в красный цвет.
Нитрат – ион NO3- аналогичной реакции не дает.
Вместо сульфаниловой кислоты используют и другие ароматические амины, а вместо 1-нафтиламина – 1 амино – 2- нафтол, 2- нафтол и т.д.
6. Реакция с солями аммония – реакция разложения (удаления) нитрит ионов.
NO2- + NH4+ → N2 + 2 H2O
Аналогична реакция с карбамидом:
2 NO2- + 2 Н+ + СО (NH2)2 → 2 N2 + СО2 + 3 H2O
Эти реакции используют для удаления нитрит – ионов из раствора.
Наблюдается выделение пузырьков газа – азота.
Чтобы убедиться в полноте протекания реакции, в пробирку прибавляют каплю раствора иодида калия KI и каплю крахмала. Если раствор не окрашивается в синий цвет, то это означает, что нитрит – ион в растворе отсутствует.
7. Реакция с антипирином (фармакопейная).
Реакцию проводят в слабо кислой среде.
Н3С – С = С - Н H3C – C = C - NO
| | + HNO2 → | | + H2O


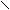
 Н3С – N C = O H3C – N C = O
Н3С – N C = O H3C – N C = O
 N – C6H5 N – C6H5
N – C6H5 N – C6H5
антипирин нитрозоантипирин (изумрудно-зеленый)
8. Другие реакции нитрит – иона.
Нитрит – ион с солями кобальта и KСl в уксуснокислой среде дает желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO)2)6]; с FeSO4 в сернокислой или уксуснокислой среде образует комплекс состава [Fe(NO)SO4] бурого цвета и т.д.
Дата добавления: 2015-04-15; просмотров: 460; Мы поможем в написании вашей работы!; Нарушение авторских прав |