
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Аналитические реакции нитрат – иона NO3-.
Нитрат – ион NO3- - анион одноосновной сильной азотной кислоты HNO3.
В водных растворах бесцветный нитрат – ион не гидролизуется, обладает окислительными свойствами. Как лиганд NO3- - мало эффективен и образует неустойчивые нитракомплексы металлов.
Нитраты металлов хорошо растворяются в воде.
В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганата калия (фармакопейный тест).
1. Реакция с дифениламином (фармакопейная).
Эта реакция – общая для NO3- и NO2- и проводится точно так же, как и для нитрит – иона (см. выше); только вместо раствора нитрита натрия используют раствор нитрата натрия или калия. Данной реакцией нельзя открывать нитраты в присутствии нитритов.
2. Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
2 NO3- + 8 H+ + 3 Cu → 3 Cu2+ + 2 NO↑ + 4 H2O
2NO + O2 ↔ 2 NO2↑(желто-бурые пары)
3. Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
3 Fe2+ + NO3- + 4 H+ → 3 Fe3+ + NO + 2 H2O
Fe2+ + NO + SO42- ↔ [Fe NO]SO4 (бурый)
Эту реакцию дает и нитрит – ион, поэтому нельзя открыть этой реакцией нитрат – ион в присутствии нитрит – иона.
Проведению реакции мешают Br-, I-, SO32-, S2O32-, CrO42-, MnO42-.
4. Реакция с металлическим алюминием или цинком.
3 NO3- + 8 Al + 5 OH- + 18 H2O → 3 NH3 + 8 [Al (OH)4]-
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.Проведению реакции мешают катионы аммония NH4+, выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (NO2-, SCN-, ферро - и феррицианид – ионы).
5. Реакция с антипирином.
Реакцию проводят в кислой среде.
Н3С – С = С – Н H3C – C = C – NO2
| | + NO3- + H+ → | | + H2O
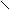


 Н3С - N C H3C – N C = O
Н3С - N C H3C – N C = O
N – C6H N – C6H5
антипирин нитроантипирин (ярко – красный)
Дата добавления: 2015-04-15; просмотров: 1639; Мы поможем в написании вашей работы!; Нарушение авторских прав |