
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергетического расщепления орбиталей
В предыдущем разделе было показано, как в соответствии с представлениями теории кристаллического поля происходит расщепление d–орбиталей под влиянием поля лигандов. Несмотря на ограниченность основополагающих постулатов ТКП оказалась способна объяснить и предсказать многие разнообразные экспериментальные факты.
v Магнитные свойства комплексов. В отличие от метода ВС, в рамках которого трактовка магнитных свойств опиралась на возможность и эффективность дополнительного π–дативного связывания с лигандами π–акцепторами (напомним, что при этом π–акцепторная активность таких лигандов, как NO2–, CN–, CO метод ВС не предсказывает – это результат применения теории молекулярных орбиталей), в ТКП магнитные свойства строго вытекают из идеи об энергетическом расщеплении d–орбиталей центрального атома. Заселение электронами вновь возникших подуровней (dε и dγ) будет определяться их энергией и межэлектронными взаимодействиями. В частности, в октаэдрических комплексах поначалу электроны будут располагаться в соответствии с правилом Хунда на низколежащих dε–орбиталях dε1, dε2, dε3. Соответствующие комплексы (например, [Ti(OH2)6]3+, [V(OH2)6]3+и [Cr(OH2)6]3+) являются парамагнитными, их магнитные моменты соответствуют наличию 1-го, 2-х и 3-х электронов, соответственно. Способ распределения 4-х электронов может быть различным и зависит от энергии расщепления Δокт. Дело в том, что добавление четвертого электрона потребует затраты энергии либо на его спаривание (Р) с одним из электронов на dε–орбиталях, либо на его возбуждение и перевод на высоколежащий dγ–подуровень (Δокт). В любом случае система предпочтет энергетически более выгодный вариант: в слабом поле образуются высокоспиновые комплексы с четырьмя неспаренными электронами (dε3dγ1), а в присутствии лигандов сильного поля – низкоспиновые комплексы с двумя неспаренными электронами (dε4).

Аналогичная конкуренция между стремлением занять низколежащую dε–орбиталь и межэлектронным отталкиванием будет определять магнитные свойства октаэдрических комплексов при наличии на орбиталях комплексообразователя от 4-х до 7-ми электронов:

При электронной конфигурации центрального атома d8, d9и d10независимо от силы поля, создаваемого октаэдрическим лигандным окружением, магнитные моменты комплексов будут совпадать и соответствовать следующему электронному распределению: dε6dγ2, dε6dγ3, dε6dγ4. Комплексы с d10–конфигурацией являются диамагнитными.
Магнитные свойства тетраэдрических комплексов с точки зрения ТКП предсказываются еще более просто: поскольку в этом случае ни один из лигандов не оказывает сильного влияние на орбитали комплексообразователя, то энергия dε–dγ-расщепления невелика (всегда выполняется условие Δтетр<Р). Поэтому все тетраэдрические комплексы являются высокоспиновыми, диамагнитны только те комплексы, в составе которых либо вообще нет d–электронов (d0), либо они попарно заселяют все орбитали центрального атома (d10).
v Спектры поглощения. Окрашенность как полимерных соединений, так и островных комплексов d–элементов впервые удалось объяснить на основе ТКП (собственно для решения этого вопроса она и была разработана и долгое время использовалась). Дело в том, что если признать устранение вырождения d–подуровня, то появляется возможность для сравнительно легкого возбуждения низколежащих электронов (dε в октаэдрах, dγ в тетраэдрических комплексах). Поскольку энергетическое расщепление в целом невелико (Δ примерно составляет 1 – 4 эВ, редко доходит до ~5 эВ), то для электронного dε→dγ–перехода может вполне оказаться достаточно энергии, которую содержат кванты излучения, входящие в состав видимого энергетического спектра (95 – 390 кДж/моль, редко – до ~ 480 кДж/моль). Схема возникновения соответствующего спектра поглощения представлена на рис.4.28.

| Рис.4.28 – Схема, иллюстрирующая возникновение окрашенности тел, веществ за счет поглощения той или иной части видимого света. |
Рассмотрим вначале да крайних случая: если какое-либо поглощает кванты всех составных частей видимого света и, тем самым, не отражает никакого излучения в видимой человеческим глазом части энергетического спектра, то такое тело будет нам представляться абсолютно черным.[43] Если же тело не поглощает энергию в видимой части спектра (соответствующие кванты не содержат энергию необходимую для каких-то возможных электронных переходов), то оно (тело, вещество, в том числе, находящееся в растворе) будет выглядеть бесцветным ("белым"). Если же образец поглощает все излучения, кроме оранжевой компоненты, то, естественно, он будет окрашен в оранжевый цвет. Возможен и другой вариант: образец поглощает энергию, соответствующую синей компоненте видимого света, а нам он будет представляться оранжевым. Дело в том, что в этом случае в отраженном (или проходящем) свете мы видим все лучи, кроме синего, а они в смеси дают оранжевый цвет. Как видно из таблицы 4.17 синий и оранжевый цвета являются дополнительными друг к другу.
Таблица 4.17
Энергия квантов видимого света
и система дополнительных цветов
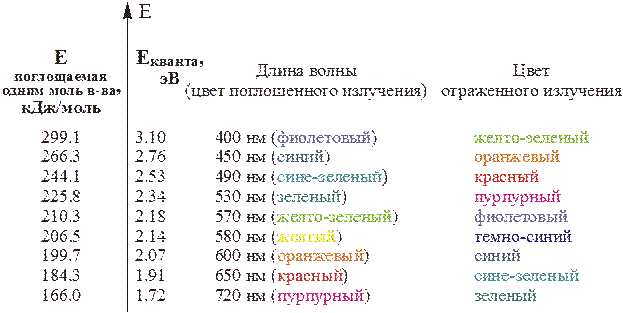
Таким образом, энергия расщепления может быть или вычислена на основе данных о структуре соединения (комплекса),[44] после чего может быть рассчитан спектр поглощения и предсказана окраска вещества. В то же время часто приходится решать и обратную задачу: по спектру (по длине волны, соответствующей максимуму поглощения) можно рассчитать энергию расщепления. Именно так были получены данные для построения спектрохимического ряда лигандов. В частности, впервые Δокт была рассчитана по спектрам поглощения аквокомплекса [Ti(OH2)6]3+, в составе которого ион Ti3+, имеет простую для интерпретации электронных спектров конфигурацию d1. В видимой области максимум поглощения (рис.4.29) приходится на электромагнитное излучение с длиной волны ~500нм (Екванта ≈ 2.48 эВ), что соответствует желто-зеленой компоненте белого дневного света. Из табл.4.17 видно, что дополнительным цветом к желто-зеленому является фиолетовый – именно эту окраску и имеют многие соединения Ti3+, ну а, если энергию излучения, поглощаемого на dε→dγ–переход пересчитать на один моль вещества, получаем энергию октаэдрического расщепления для [Ti(OH2)6]3+: Δокт ≈ 239кДж/моль.

| Рис.4.29 – Спектр поглощения иона [Ti(OH2)6]3+ |
Интенсивное поглощение в ультрафиолетовой части спектра обусловлено так называемым переносом заряда (ППЗ), т.е. электронными переходами между сильно расщепленными заселенными электронами орбиталями лигандов и вакантными орбиталями центрального атома. Такие переходы могут анализироваться только в рамках ММО. Уширенность и несимметричность полос поглощения в видимой части спектра (за счет d–d-переходов) обусловлена эффектами Яна-Теллера (обсудим позже) и постоянными колебаниями по связям М–L, что делает лигандное окружение несколько несимметричным.
v Некоторые структурные и термодинамические последствия расщепления.
До сих пор главное внимание было уделено влиянию электростатического поля лигандов на d–электроны, создаваемые ими электронные облака. В поле лигандов d–электроны стремятся избегать определенные области пространства и предпочитают находиться в других местах, т.е. предпочитают одни орбитали другим. Теперь коротко рассмотрим вопрос о том, каким образом несферическое распределение d–электронов, возникающее в поле лигандов, в свою очередь влияет на координационное окружение центрального атома. Напомню, что активное использование ТКП химиками началось, когда было показано, что она позволяет объяснить своеобразную вторичную периодичность в изменении энергии кристаллических решеток дигалогенидов 3d–металлов, немонотонный характер изменения кристаллохимических ионных радиусов d–элементов и др.
Ø Распространенность октаэдрической координации. На основе ионных представлений о взаимодействии комплексообразователь–лиганд следует простой качественный вывод о зависимости КЧ от размеров и заряда центрального иона и лигандов. В то же время явно бросается в глаза преимущественная распространенность октаэдрических комплексов, причем в некоторых случаях, как, например, у Cr3+никакая другая координация, кроме октаэдрической, вообще не наблюдается. Подобные факты становятся более понятными после сравнения энергий стабилизации тех или иных электронных конфигураций комплексообразователя в октаэдрическом и тетраэдрическом окружениях.
Из уравнений (4.16) следует, что заселение dε–орбиталей т электронами обеспечит энергию стабилизации кристаллическим полем
ЕСКП = т·0.4·Δокт. (4.19)
Если при этом оказываются частично заселены (скажем, n электронами) dγ–орбитали, то это отразится на ЕСКП:
ЕСКП = т·0.4·Δокт – n·0.6·Δокт. (4.20)
Таблица 4.18
Сравнение энергии стабилизации
в октаэдрических и тетраэдрических комплексах,
обоснование электронной стабилизации октаэдрического окружения
| dn | октаэдрический комплекс | тетраэдр. комплекс | ЕСОО | ||||||
| Δокт < P | Δокт > P | ||||||||
| электр. конф. | ЕСКП | электр. конф. | ЕСКП | электр. конф. | ЕСКП | ЕСКП в пересчете на Δокт | для слабого октаэдрического поля | для сильного октаэдрического поля | |
| d0 | dε0dγ0 | dε0dγ0 | dγ0dε0 | ||||||
| d1 | dε1dγ0 | 0.4·Δ | dε1dγ0 | 0.4·Δ | dγ1dε0 | 0.6·Δтетр | 0.27·Δокт | 0.13·Δокт | 0.13·Δокт |
| d2 | dε2dγ0 | 0.8·Δ | dε2dγ0 | 0.8·Δ | dγ2dε0 | 1.2·Δтетр | 0.53·Δокт | 0.27·Δокт | 0.27·Δокт |
| d3 | dε3dγ0 | 1.2·Δ | dε3dγ0 | 1.2·Δ | dγ2dε1 | 0.8·Δтетр | 0.36·Δокт | 0.84·Δокт | 0.84·Δокт |
| d4 | dε3dγ1 | 0.6·Δ | dε4dγ0 | 1.6·Δ–Р | dγ2dε2 | 0.4·Δтетр | 0.18·Δокт | 0.42·Δокт | 1.42·Δокт–Р |
| d5 | dε3dγ2 | dε5dγ0 | 2.0·Δ–2Р | dγ2dε3 | 2.0·Δокт–2Р | ||||
| d6 | dε4dγ2 | 0.4·Δ | dε6dγ0 | 2.4·Δ–2Р | dγ3dε3 | 0.6·Δтетр | 0.27·Δокт | 0.13·Δокт | 2.27·Δокт–2Р |
| d7 | dε5dγ2 | 0.8·Δ | dε6dγ1 | 1.8·Δ–Р | dγ4dε3 | 1.2·Δтетр | 0.53·Δокт | 0.27·Δокт | 1.53·Δокт–Р |
| d8 | dε6dγ2 | 1.2·Δ | dε6dγ2 | 1.2·Δ | dγ4dε4 | 0.8·Δтетр | 0.36·Δокт | 0.84·Δокт | 0.84·Δокт |
| d9 | dε6dγ3 | 0.6·Δ | dε6dγ3 | 0.6·Δ | dγ4dε5 | 0.4·Δтетр | 0.18·Δокт | 0.42·Δокт | 0.18·Δокт |
| d10 | dε6dγ4 | dε6dγ4 | dγ4dε6 |
Примечание: Δокт и Δокт отличаются из-за разного расщепляющего воздействия лигандов слабого и сильного поля.
Дополнительным дестабилизирующим фактором может стать появление новых (по сравнению с электронным строением центрального атома в сферическом поле лигандов) электронных пар. На их образование потребуются энергетические затраты, кратные энергии спаривания:
ЕСКП = т·0.4·Δокт – n·0.6·Δокт – х·Р. (4.21)
Последнее слагаемое приходится принимать во внимание только в комплексах с лигандами сильного поля. Аналогичные выражения могут быть получены и для тетраэдрических комплексов (см. 4.17 и 4.18). Последнее выражение нужно обязательно учитывать при сравнении энергий стабилизации в октаэдрическом и тетраэдрическом окружении, для нахождения энергии стабилизации октаэдрического окружения ЕСОО
относительно тетраэдрического. Из результатов, обобщенных в таблице 4.18, видно, что при отсутствии пространственных затруднений октаэдрические комплексы всегда более выгодны, чем тетраэдрические. Предпочтение к октаэдрам отсутствует только при электронных конфигурациях d0, d10 и d5 (в слабом поле лигандов). Соответствующими примерами в химии d–элементов могут служить нередко тетраэдрически координированные крупными лигандами ионы Ti4+ (d0), Zn2+(d10), и Mn2+, Fe3+(d5).
Ø Кристаллохимические ионные радиусы.Сравним октаэдрическиерадиусыдвухзарядных ионов элементов первого переходного ряда (рис.4.30). Вследствие неполного экранирования d–электронов от растущего заряда ядра ионный радиус имеет тенденцию к уменьшению. Однако радиусы только трех ионов (Са2+, Mn2+ и Zn2+) меняются в соответствии с теоретическими ожиданиями. С точки зрения ТКП это можно объяснить тем, что только данные ионы имеют сферически симметричные электронные облака (для Mn2+это условие выполняется только в слабом октаэдрическом поле): электронные конфигурации d0, dε3dγ2, и dε6dγ4, соответственно.
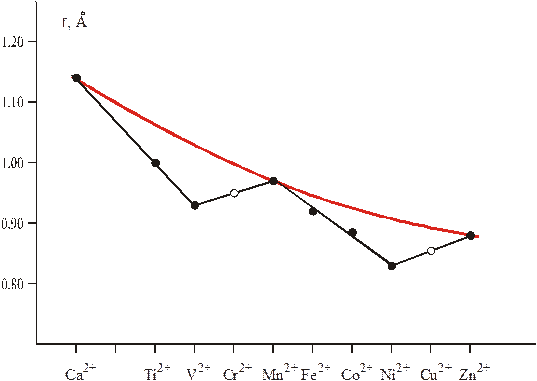
| Рис.4.30 – Кристаллохимические ионные радиусы Ме2+ в слабом поле лигандов. Плавная красная линия соответствует теоретической зависимости. |
Ион Ti2+имеет электронную конфигурацию dε2dγ0, при которой два его электрона локализованы преимущественно вдали от связей M–L и поэтому плохо экранируют лиганды от заряда центрального атома. За счет этого лиганды сближаются с ним сильней, чем это могло бы произойти в случае сферически симметричного электронного облака. Как следствие, расстояние M–L, соответственно и кристаллохимический ионный радиус Ti2+оказываются заниженными по сравнению с гипотетическим изоэлектронным сферическим ионом. Еще сильней данный эффект должен сказываться на занижении ионного радиуса V2+. В то же время по мере заселения dγ–орбиталей (Cr2+– dε3dγ1и Mn2+ – dε3dγ1) растет электронная плотность в пространстве между комплексообразователем и лигандами, усиливается экранирование последних и растут длины связей M–L, кристаллохимические радиусы соответствующих ионов. По тем же причинам в ряду Mn2+ – Zn2+ ионные радиусы также проходят через минимум, который наблюдается у элемента, имеющего самую высокую ЕСКП в октаэдрическом окружении слаборасщепляющих лигандов.
Нетрудно понять, что в присутствии лигандов сильного поля схема изменения октаэдрических ионных радиусов должна иметь лишь один минимум (для иона Fe2+).
Аналогичные результаты могут быть получены при анализе кристаллохимических радиусов в сильном октаэдрическом или в тетраэдрическом поле лигандов.
Ø Энтальпии гидратации ионов. На рисунке 4.31 представлена зависимость ΔН°гидр(Мe2+)
Мe2+(газ) + ∞ Н2О(ж) → [Мe(OH2)6]2+(aq)
от электронного строения соответствующих аквокомплексов. Значения ΔН°гидр(Мe2+) (на рис.12.7 они показаны черными точками) рассчитываются с использованием цикла Борна-Габера. Видно, что сферически симметричные ионы, для которых ЕСКП равна нулю, располагаются на плавной кривой. Остальные значения лежат выше. Если из них вычесть ЕСКП, то вновь полученные точки (обозначены светлыми кружками) попадают на указанную кривую.
Это означает, что Δокт, рассчитанные по спектрам поглощения, лежащие в основе расчетов ЕСКП, позволяют в итоге объяснять, правильно понимать важные структурные и термодинамические свойства комплексов, что, в свою очередь, подтверждает основополагающую идею ТКП о расщеплении d–орбиталей комплексообразователя в поле лигандов.

| Рис.4.31 – Энергия гидратации (–ΔН°гидр) Ме2+. Плавная красная линия соответствует теоретической зависимости. (Черными точками проставлены экспериментальные значения, светлыми – исправленные на величину ЕСКП.) |
Ø Эффект Яна-Теллера и квадратное поле лигандов. В 1937г. Г.А.Ян и Э.Теллер сформулировали важную для стереохимии теорему: если орбитальное состояние какого-либо иона вырождено по симметрии, то в поле лигандов произойдет снятие вырождения и состоится переход в более стабильное состояние (с меньшей энергией) с пониженной симметрией. Несмотря на довольно абстрактную формулировку, эта простая теорема имеет большое практическое значение, т.к. позволяет понять структурные особенности целого ряда соединений переходных элементов.
Рассмотрим, в качестве примера, октаэдрические комплексы Cu2+. Из таблицы 4.18 следует, что, независимо от силы поля лигандов, они всегда имеют электронное строение dε6dγ3, причем dγ–орбитали могут быть заселены по-разному: dz22dx2-y21 или dz21dx2-y22.
Предположим, что в каком-либо октаэдрическом комплексе [CuL6] (КЧ = 6) реализуется первый способ распределения электронов. Но тогда электростатическое притяжение двух лигандов, располагающихся вдоль оси z, будет экранировано сильней, чем притяжение тех четыре, что располагаются в плоскости ху. Это приведет к тетрагональному искажению октаэдра: четыре связи в плоскости ху окажутся короче, чем две, располагающиеся перпендикулярно (вдоль оси орбитали dz2) – [CuL4L2], КЧ = 4+2. Искажение октаэдра, в свою очередь, вызовет дополнительное расщепление d–орбиталей и новое перераспределение энергии между ними. Те орбитали, которые имеют ху–направленность (dx2-y2 и, некоторой степени, dxy) испытают дополнительное отталкивание от приблизившихся лигандов и, соответственно, повысят свою энергию. В свою очередь орбитали dz2и, в некоторой степени, dxz и dyz, наоборот, свою энергию несколько понизят (рис.4.32). Это приведет к дополнительному энергетическому расщеплению dε– и dγ–подуровней, причем δε < δγ ≪ Δокт. Причем, суммарная энергия электронов на слабо расщепленном dε–подуровне остается неизменной, а вот на dγ–подуровне достигается дополнительная стабилизация: суммарная энергия уменьшается на величину 0.5δγ.

| Рис.4.32 – Схематичная диаграмма расщепления, вызванного удлинением октаэдра за счет эффекта Яна-Теллера. Величины расщеплений приведены в разном масштабе: Δокт >> δγ > δε. |
Если поменять исходное предположенсие и представить заселение dγ–подуровня в виде dz21dx2-y22, то, как следствие, изменится схема искажения октаэдра ([CuL2L4], КЧ = 2+4), а схема дополнительного расщепления d–орбиталей окажется зеркально симметричной по сравнению с разобранной выше. Какой из этих двух вариантов реализуется на практике, из теоремы Яна-Теллера однозначно не следует, но как можно видеть из данных таблицы 12.10, вытянутые октаэдры встречаются чаще, чем сплющенные. Это может быть объяснено большей энергетической выгодой от сохранения большего числа связей в ближайшей координационной сфере (КЧ = 4+2).
Аналогичные механизмы вызывают Ян-Теллеровские искажения во всех случаях, когда dγ–подуровень октаэдрически координированного атома содержит нечетное число электронов:
d4,высокоспиновые комплексы: Cr2+, Mn3+
d7,низкоспиновые комплексы: Cо2+, Ni3+
d9,комплексы: Cu2+, Ag2+.
Формально эффект Яна-Теллера возможен и при неполном заполнении dε–орбиталей, однако на настоящий момент не известно ни одного структурно подтвержденного примера такого рода. По-видимому, это связано с тем, что dε–электронные облака располагаются между лигандами, а, поэтому, несимметричное заселение орбиталей мало сказывается на взаимодействии M–L.
Таблица 4.19
Межатомные расстояния в некоторых соединениях,
структуры которых искажены из-за эффекта Яна-Теллера
| состав | межатомные расстояния, Å | комментарий |
| CuF2 | 1.93(4F)+2.27(2F) | Трехмерный полимер с искаженной структурой рутила |
| CuCl2 | 2.30(4Cl)+2.95(2Cl) | Цепочечный полимер (с очень слабыми межцепочечными связями) |
| CuBr2 | 2.40(4Br)+3.18(2Br) | Цепочечный полимер (с очень слабыми межцепочечными связями) |
| Na2CuF4 | 1.91(4F)+2.37(2F) | Трехмерный полимер, содержащий очень прочный плоский остов, дополнительно сшитый в перпендикулярном направлении |
| K2CuF4 | 1.95(2F)+2.08(4F) | Трехмерный полимер, содер-жащий особенно прочные связи в цепях –Cu–F–Cu– |
| α-Cu(NH3)2Br2 | 1.93(2NH3) 2.54(2Br) 3.08(2Br) | Цепочечный полимер (с очень слабыми межцепочечными связями) |
| β-Cu(NH3)2Br2 | 2.03(2NH3) 2.88(4Br) | Кристалл построен из островных ионов |
| CuO | 1.96(4O)+2.78(2O) | Практически плоский полимер |
| CrF2 | 2.00(4F)+2.43(2F) | Трехмерный полимер с сильно искаженной структурой рутила |
| MnF3 | 1.79(2F)+1.91(2F)+2.09(2F) | Трехмерный полимер с искаженной структурой VF3 |
Поучительным примером, подтверждающим возможности ТКП в объяснении, предсказании особенностей структур соединений d–элементов, в том числе, с учетом проявления эффекта Яна-Теллера может служить смешанный оксид марганца гаусманит Mn3O4. В некоторых источниках утверждается, что в его составе атомы марганца имеют степени окисления +II и +IV ("MnO·MnO2"). Однако анализ структуры свидетельствует о том, что 2/3атомов марганца находятся в искаженно октаэдрическом окружении. Это невозможно при электронных конфигурациях d5 (Mn2+) и d3 (Mn4+), но вполне ожидаемо для атомов Mn3+с электронной формулой d4. Формула, отражающая этот факт, должна быть записана как MnO·Mn2O3, а, учитывая, что гаусманит имеет структуру шпинели, то – MnMn2O4. В структуре оксидах со структурой шпинели часть катионов заселяет тетраэдрические позиции (имеют окружение МО4), а часть – октаэдрические (МО6). В структуре Mn3O4 эти координационные группировки выглядят следующим образом:  и
и  , что согласуется с предсказываемыми теорией кристаллического поля координационными предпочтениями атомов с электронными конфигурациями d5 (Mn2+) и d4 (Mn3+).
, что согласуется с предсказываемыми теорией кристаллического поля координационными предпочтениями атомов с электронными конфигурациями d5 (Mn2+) и d4 (Mn3+).
Анализ структурных данных, представленных в таблице 4.19, свидетельствуют о том, что при сильном Ян-Теллеровском искажении октаэдров в пределе могут быть получены квадратные (КЧ = 4+…0) или линейные (КЧ = 2+…0) комплексы. На рисунке 4.33 показаны схемы расщепления в полях разной симметрии, а в таблице 4.20 приведены энергии орбиталей в единицах Dq.
Таблица 4.20
Относительные энергии d–орбиталей в зависимости
от структуры комплекса.
(Ось z является осью высшего порядка)
| КЧ | Структура комплекса | Энергия орбиталей в единицах Dqокт | ||||
| dz2 | dx2-y2 | dxy | dxz | dyz | ||
| линия | 10.28 | -6.28 | -6.28 | 1.14 | 1.14 | |
| треугольник | -3.21 | 5.46 | 5.46 | -3.86 | -3.86 | |
| тетраэдр | -2.67 | -2.67 | 1.78 | 1.78 | 1.78 | |
| квадрат | -4.28 | 12.28 | 2.28 | -5.14 | -5.14 | |
| 4+1 | кв. пирамида | 0.86 | 9.14 | -0.86 | -4.57 | -4.57 |
| октаэдр | 6.00 | 6.00 | -4.00 | -4.00 | -4.00 | |
| триг. призма | 0.96 | -5.84 | -5.84 | 5.36 | 5.36 | |
| куб | -5.34 | -5.34 | 3.56 | 3.56 | 3.56 |

| Рис.4.33 – Схемы расщепления d–орбиталей в полях различной симметрии. |
Ø Стабилизация степеней окисления. Теорию кристаллического поля порой используют для анализа окислительно-восстановительных свойств комплексов, для сопоставления относительной стабильности различных степеней окисления d–элемента в том или ином лигандном окружении. Однако следует признать, что это слишком многопараметрическая проблема и бесспорно убедительным ее решение в рамках ТКП выглядит только тогда, когда начальное или конечное состояние окислительно-восстановительного перехода представляет собой октаэдрический комплекс, в составе которого центральный атом (ион) имеет высоколежащие dγ–электроны. Самыми убедительными и наглядными примерами такого рода являются комплексы Со2+(электронная конфигурация d7). При значительном увеличении энергии расщепления (при переходе электронного распределения dε5dγ2от к dε6dγ1) потеря седьмого электрона и переход в степень окисления +III резко облегчается, что отражается Red/Ox потенциале равновесия Со2+/Со2+:
| [Со(OH2)6]3++ ē ⇄ [Со(OH2)6]2+ | φ° = 1.808 В |
| [Со(NH3)6]3++ ē ⇄ [Со(NH3)6]2+ | φ° = 0.108 В |
| [Со(en)3]3++ ē ⇄ [Со(NH3)3]2+ | φ° = –0.260 В |
| [Со(CN)6]3– + ē ⇄ [Со(CN)6]4– или более строго [Со(CN)6]3– + H2O + ē ⇄ [Со(CN)5ОН2]3–+ CN– | φ° = –0.830 В |
Гораздо больше примеров предсказания в вопросах стабилизации тех или иных степеней окисления основано на анализе предрасположенности различных d–элементов к связыванию с определенного типа лигандами (в частности, с учетом возможности дополнительного π–связывания). Но это вовсе не поле деятельности ТКП.
Дата добавления: 2014-11-13; просмотров: 1504; Мы поможем в написании вашей работы!; Нарушение авторских прав |