
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теория кристаллического поля
Впервые идеи и математический аппарат теории кристаллического поля (ТКП) были изложены немецким физиком Г.Бете в 1929г. Как и в простой ионной модели, взаимодействие комплексообразователь–лиганд подразумеваются чисто электростатическим. При этом лиганды рассматриваются как бесструктурные точечные отрицательные заряды (реже диполи). В то же время электронное строение центрального атома (теория ориентирована на анализ свойств соединений переходных элементов) анализируется подробно, в частности энергия d(или f–)–орбиталей рассчитывается с использованием уравнения Шредингера в зависимости от симметрии и напряженности электрического поля, создаваемого лигандами:
 , где
, где  (4.11)
(4.11)
 – гамильтониан свободного (газообразного) иона;
– гамильтониан свободного (газообразного) иона;
V – оператор, описывающий взаимодействие этого иона с электрическим полем лигандов.
Чтобы получить выражения для собственных волновых функций оператора  , а затем и собственные значения энергии Е, необходимо использовать математический аппарат квантовой механики. Но это выходит за рамки настоящего учебника, поэтому выскажем лишь несколько общих соображений, а затем рассмотрим итоги соответствующих расчетов на качественном уровне. Бете показал, что под влиянием поля лигандов снимается пятикратное вырождение d–подуровня (происходит его энергетическое расщепление на несколько новых энергетических состояний). Схема расщепления зависит от симметрии поля лигандов, а энергия расщепления – от значения V. При очень малых V электронные состояния центрального атома практически не меняются (это имеет место в комплексах f–элементов, т.к. f–орбитали ионов сильно стабилизируются в положительных степенях окисления). При некотором увеличении V происходит расщепление d–подуровня, но энергия расщепления невелика и не превышает межэлектронного взаимодействия – реализуется ситуация «слабого поля лигандов», характерная для многих комплексов 3d–элементов. При еще большем значении V энергия расщепления превышает энергию межэлектронного отталкивания, что характерно для случая « сильного поля лигандов « (наблюдается в целом ряде комплексов 3d–элементов и практически во всех комплексах 4d– и 5d–элементов).
, а затем и собственные значения энергии Е, необходимо использовать математический аппарат квантовой механики. Но это выходит за рамки настоящего учебника, поэтому выскажем лишь несколько общих соображений, а затем рассмотрим итоги соответствующих расчетов на качественном уровне. Бете показал, что под влиянием поля лигандов снимается пятикратное вырождение d–подуровня (происходит его энергетическое расщепление на несколько новых энергетических состояний). Схема расщепления зависит от симметрии поля лигандов, а энергия расщепления – от значения V. При очень малых V электронные состояния центрального атома практически не меняются (это имеет место в комплексах f–элементов, т.к. f–орбитали ионов сильно стабилизируются в положительных степенях окисления). При некотором увеличении V происходит расщепление d–подуровня, но энергия расщепления невелика и не превышает межэлектронного взаимодействия – реализуется ситуация «слабого поля лигандов», характерная для многих комплексов 3d–элементов. При еще большем значении V энергия расщепления превышает энергию межэлектронного отталкивания, что характерно для случая « сильного поля лигандов « (наблюдается в целом ряде комплексов 3d–элементов и практически во всех комплексах 4d– и 5d–элементов).
Поначалу ТКП использовалась только физиками для изучения главным образом тонких деталей магнитных и спектральных свойств соединений d–металлов. Химики обратились к этой теории примерно через 20 лет, когда окрепло понимание ограниченности МВС, ее непреодолимой подчиненности экспериментальным фактам (слабой предсказательной силе). В то же время ТКП, как удалось показать, оказалась способной объяснять и прогнозировать не только магнитные, спектральные, но и многие другие, как структурные, так и термодинамические, кинетические свойства соединений d–элементов, том числе и островных комплексов.
Рассмотрим вначале на качественном уровне причины, приводящие к тем или иным схемам расщепления d–орбиталей в самых распространенных комплексах с октаэдрической (КЧ=6) и тетраэдрической (КЧ=4) симметрией (рис.12.3, на схеме не показан вклад в общую энергию системы от кулоновского взаимодействия М–L). Но при этом важным обязательным промежуточным этапом рассуждений является случай так называемого «сферического поля» (КЧ=∞).
Вначале напомним, что ионизация атома уменьшает эффект экранирования d–орбиталей, что приводит к их более сильному притяжению к ядру (способствует понижению энергии). Если теперь представить, что к газообразному (изолированному) иону d–металла будет приближено бесконечное число отрицательных лигандов (строго говоря, электростатическое взаимодействие, лежащее в основе этого процесса ненасыщаемо и ненаправлено), то, несмотря на общую энергетическую выгодность сближения разноименно заряженных частиц, появится и будет усиливаться отталкивание между отрицательно заряженными лигандами и d–облаками центрального атома. Это равносильно "дестабилизирующему" вкладу в общую энергию взаимодействия, соответствующее повышение энергии приписывают d–орбиталям (раз уж мы договорились следить за их энергией). Поскольку сфера абсолютно симметрична, то все d–орбитали испытывают одинаковое отталкивание от отрицательных лигандов и поэтому их энергия одинаково растет. Однако пятикратное вырождение снимается при переходе от гипотетического комплекса [ML∞] к рассмотрению реальных случаев, например, при понижении симметрии поля лигандов до октаэдрического. Это достигается в результате следующего мысленного

Рис.4.27 – Зависимость энергии d–орбиталей от симметрии поля лигандов.
эксперимента: «лишние» лиганды при этом не удаляются, концентрируются в шести эквивалентных точках сферы, образуя октаэдр вокруг центрального атома. Нетрудно понять, что эти точки (шесть объединенных точечных лигандов) располагаются попарно на трех взаимно перпендикулярных осях координат. Полезно также отметить, что, если представить эту сферу вписанной в куб, соответствующие шесть лигандов окажутся в центрах его граней (рис.4.27). Такое перераспределение лигандов приводит и к перераспределению энергии между d–орбиталями. Те орбитали (dε или в соответствии с терминологией, принятой в теории групп – t2g: dxy, dxz, dyz), от которых лиганды отдаляются, несколько понижают свою энергию, т.к. они теперь испытывают более слабое отталкивание от отрицательно заряженной октаэдрической группировки. В то же время dγ–орбитали (или еg: dx2-y2, dz2), лепестки которых вытянуты строго вдоль декартовых осей координат, испытывают возросшее отталкивание от полученной группировки лигандов и повышают свою энергию. Таким образом при октаэдрической координации центрального атома dε стабилизируются, dγ – дестабилизируются по сравнению со сферическим комплексом. Однако общий достигнутый d–орбиталями запас энергии (Ео) при этом сохраняется неизменным, она лишь перераспределяется между двумя новыми подсистемами (подуровнями). Величину возникающего энергетического расщепления принято обозначать как Δокт или 10Dqокт:
Еdγ – Еdε= Δокт или Еeg– Еt2g= 10Dqокт. , (4.12)
тогда при полном заселении d–орбиталей электронами
4·Еdγ + 6·Еdε= 10Ео или 4·Еeg+ 6·Еt2g= 10Ео (4.13)
Если теперь выразить энергетическую стабилизацию и дестабилизацию соответствующих орбиталей относительно сферического поля как
х = Ео – Еdε или х = Ео – Еt2g (4.14)
у = Еdγ – Ео или у = Еeg– Ео , (4.15)
то после несложных преобразований получаем
 ;
;  . (4.16)
. (4.16)
Отметим, что величина Δокт, как уже отмечалось ранее, зависит от V, т.е. от природы лигандов. В рамках ТКП нет достаточных инструментов, чтобы предсказывать, сравнивать влияние разных лигандов (кроме заряда, размера и дипольного момента) – это плата за упрощение теории. В то же время обобщение многочисленных экспериментальных данных о магнитных и оптических свойствах комплексов позволили сделать вывод, что все лиганды могут быть систематизированы по величине Δокт,[42] и, как минимум, они могут быть поделены на группу лигандов сильного поля (Δокт > Р - энергии на спаривание электронов, связанная с энергией межэлектронного отталкивания) и группу лигандов слабого поля (Δокт < Р). В соответствующих комплексах схема расщепления d–подуровня выглядит одинаково, но сильно различаются энергии расщепления (рис.4.27, табл.4.15).
Таблица 4.15
Зависимость Δокт от природы лигандов
| Состав комплекса | Δокт, Кдж/моль | Состав комплекса | Δокт, Кдж/моль |
| [Cr(OH2)6]3+ | [Co(OH2)6]3+ | ––– | |
| [CrF6]3– | [CoF6]3– | ||
| [Cr(NH3)6]3+ | [Co(NH3)6]3+ | ||
| [Cr(CN)6]3– | [Co(CN)6]3– |
Чтобы понять схему расщепления d–орбиталей в поле тетраэдрической симметрии, необходимо представить расположение соответствующей лигандной группировки относительно орбиталей центрального атома. В этом случае удобно изобразить куб, вписанный в сферу лигандов. Тетраэдрический комплекс из сферического будет получен, если все лиганды равномерно сосредоточить в четырех из восьми вершин куба, как это показано на рис 4.27. При этом ни одна из орбиталей не ориентируется строго на лиганды: лепестки dε–орбиталей проходят через центры граней куба, лепестки dγ–орбиталей – через центры ребер. Нетрудно понять, что dε–орбитали к лигандам оказываются ближе, испытывают более сильное отталкивание и, соответственно, дополнительно повышают свою энергию по сравнению со сферическим комплексом. В то же время от dγ–орбиталей лиганды несколько отдаляются, что способствует их энергетической стабилизации. Выполнив преобразования, аналогичные (4.12-4.16), можно показать, что
 ;
; 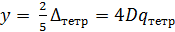 . (4.17)
. (4.17)
Важно отметить, что, поскольку в тетраэдрическом комплексе лиганды в целом располагаются дальше от d–орбиталей комплексообразователя, то они испытывают более слабое воздействие лигандов, поэтому тетраэдрическое расщепление сильным не бывает (  < P). Расчеты показывают, что, если в комплексах [ML6] и [ML4]тетр одинаковые лиганды находятся на равных расстояниях от комплексообразователя, то
< P). Расчеты показывают, что, если в комплексах [ML6] и [ML4]тетр одинаковые лиганды находятся на равных расстояниях от комплексообразователя, то
 . (4.18)
. (4.18)
Энергия расщепления зависит не только от симметрии поля лигандов, но и от ряда других факторов (табл.4.15 и 4.16).
Таблица 4.16
Влияние природы комплексообразователя и
лигандов на величину Δ
| [M(OH2)6]2+ | Δокт, кДж/моль | [M(OH2)6]3+ | Δокт, кДж/моль | [M(NH3)6]3+ и для сравнения [Co(CN)6]3– | Δокт, кДж/моль |
| [V(OH2)6]2+ | [V(OH2)6]3+ | [Co(NH3)6]3+ | |||
| [Cr(OH2)6]2+ | [Cr(OH2)6]3+ | [Co(CN)6]3– | |||
| [Mn(OH2)6]2+ | [Mn(OH2)6]3+ | [Rh(NH3)6]3+ | |||
| [Fe(OH2)6]2+ | [Fe(OH2)6]3+ | [Ir(NH3)6]3+ | |||
| [NiCl6]4– | Δокт = 87 кДж/моль | [NiCl4]2– | Δтетр = 36 кДж/моль | [Ni(CN)4]2– | Δквадр= 393 кДж/моль |
1. Число и расположение лигандов. Уже при анализе октаэдрических и тетраэдрических комплексов было показано, что Δ зависит от того насколько близко располагаются лиганды к d–облакам центрального атома. В главе 4.5.2.3 мы рассмотрим и другие способы снятия пятикратного вырождения d–подуровня в зависимости от пространственного окружения комплексообразователя, в том числе коротко обсудим способы расчета энергии расщепления.
2. Природа центрального атома:Из таблиц 4.15 и 4.16 видно, что Δ в общем случае сложным образом зависит от таких параметров комплексообразователя, как его размер и электронное строение. Проще всего систематизировать роль заряда атома и номера главного квантового числа валентных орбиталей.
а) степень окисления. Повышение степени окисления центрального атома приводит к увеличению энергии расщепления, что согласуется с электростатическими представлениями, лежащими в основе ТКП. Чем больше заряд иона Мn+, тем сильней он притягивает отрицательно заряженные лиганды, а они, соответственно, сильней влияют на его d–орбитали. Исходя из формулы для энергии кулоновского взаимодействия, можно показать, что изменение степени окисления от +II до +III должно привести к увеличению Δ на 50%. Как показано в табл.4.16, этот результат неплохо согласуется с приведенными экспериментальными данными. В то же время ТКП плохо объясняет энергии расщепления в тех комплексах, где d–элемент находится в необычных степенях окисления (например, оксокомплексы, в составе которых металл имеет "предвысшие" степени окисления или цианидные, карбонильные комплексы М+I, М0 и, тем более, в отрицательных в степенях окисления).
б) тип d–орбиталей. В составе однотипных комплексов различия в степени расщепления d–подуровня центрального атома для элементов одного периода Периодической системы обычно невелики. А вот при переходе от 3d– к 4d– и затем к 5d–элементу Δокт обычно систематически увеличивается на ~50% и ~30%, соответственно. Это качественно объясняется увеличением размера d–электронных облаков и более сильным их взаимодействием с электрическим полем лигандов. В свою очередь, следствием растущей энергии расщепления становится тот факт, что практически все комплексы 4d– и 5d–элементов оказываются низкоспиновыми (спинспаренными).
3. Природа лигандов. В результате экспериментального исследования спектров поглощения большого числа октаэдрических комплексов было показано, что по способности вызывать расщепление d–подуровня важнейшие лиганды можно расположить в следующем порядке, называемом спектрохимическим рядом лигандов:

При анализе полученной закономерности можно заметить, что сила поля лигандов зависит от типа донорного атома: Г(S) – О – N – C (в том числе и в случае амбидентантных лигандов). Эта явно бросающаяся в глаза особенность, а также тот факт, что некоторые молекулы создают заметно более сильное расщепляющее поле, нежели анионные лиганды плохо коррелируют с электростатическими представлениями ТКП. Аналогичные противоречия возникают в связи с расположением нейтральных молекул в спектрохимическом ряду – их дипольные моменты в целом уменьшаются: (μ(Н2О) = 1.85Д, μ(NН3) = 1.47Д, μ(N2Н4) = 1.86Д, μ(Р(С6Н5)3 = 1.34Д, μ(СО) = 0.11Д).
Кроме того следует иметь в виду, что:
– данный ряд является усредненным и в отдельных конкретных случаях очередность некоторых близкорасположенных лигандов может меняться;
– данный ряд построен для комплексов в которых центральный атом имеет традиционные степени окисления (+II или +III, более менее удовлетворительные результаты может дать и для комплексов М+IV).
Варианты проявления
Дата добавления: 2014-11-13; просмотров: 774; Мы поможем в написании вашей работы!; Нарушение авторских прав |