
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электростатическая (ионная) теория
Электростатическая (ионная) теория химической связи в комплексах, основанная на использовании электронного строения атомов, была предложена Косселем и Магнусом в 1915–1922гг., т.е. еще до разработки современной квантово-механической модели атома. Неудивительно, что с ее помощью удалось решить лишь очень небольшой круг вопросов теории комплексов.
В основе ионной теории лежат представления об электростатическом притяжении положительно заряженного комплексообразователя и отрицательно заряженных лигандов. Причем, используя законы кулоновского взаимодействия, удалось расчетным путем обосновать энергетически выгодные КЧ в зависимости от зарядов и размеров комплексообразователя и лигандов.[39] Например, образование комплекса [AgJ2]–энергетически выгодно, т.к. сила притяжения ионов Ag+ и J– определяемая формулой
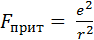 , (4.8)
, (4.8)
в четыре раза превышает силы отталкивания ионов J– (рис. 12.1):
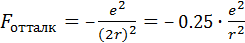 , (4.9)
, (4.9)
где коэффициент 0.25 называется коэффициентом экранирования (Кэкр). Он показывает, в какой степени притяжение комплексообразователь–лиганды скомпенсировано взаимным отталкиванием самих лигандов. Связывание дополнительных лигандов, увеличение КЧ возможно до тех пор, пока коэффициент экранирования не достигнет единицы. Расчеты показывают,
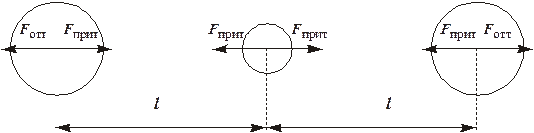
| Рис.4.25 – Силовые взаимодействия при образовании комплекса [AgJ2]– |
что при взаимодействии однозарядных ионов в зависимости от концентрации L– в растворе возможно образование комплексов [ML2]–, [ML3]2–(образование иона [ML4]3– крайне маловероятно, табл. 4.10).
Таблица 4.10
Коэффициенты экранирования, координационные числа,
геометрическая конфигурация комплексов состава 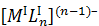 .
.
| КЧ | Кэкр | Геометрическая форма | КЧ | Кэкр | Геометрическая форма |
| 0.25 0.58 0.92 0.96 |

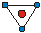

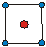
| 1.38 1.66 1.83 |
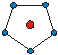
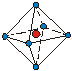
|
Увеличение заряда комплексообразователя влечет за собой увеличение сил притяжения комплексообразователь–лиганды, что равносильно увеличению КЧ. Было показано, что однозарядные катионы должны иметь координационные числа 2 и 3, двухзарядные – 4, для трехзарядных ионов КЧ могут иметь значения 4, 5, 6. С другой стороны, увеличение заряда лигандов должно усиливать экранирование и приводить к уменьшению КЧ.
Однако такие расчеты справедливы лишь для сферически симметричных ионов (в том случае, если лиганды одноатомны, и, к тому же, подобно центральному иону, имеют заполненную оболочку инертного газа). Для комплексов переходных элементов данная теория часто давала результаты, которые не согласовывались с экспериментом.
В качестве положительного момента можно отметить, что ионная модель, опираясь на простые геометрические соображения, предлагала наглядное объяснение зависимости координационных чисел от размеров центрального атома и лигандов. Но, в то же время, в химии переходных элементов более крупные ионы 4d– и 5d–рядов нередко образуют более стабильные комплексы, чем меньшие по размеру ионы 3d–элементов.
Кроме значений координационных чисел, ионная теория не объясняла возможности образования квадратных координаций, не говоря уже об электронных состояниях комплексов. Например: фторидный комплекс Fe2+([FeF6]4–) обладает парамагнитными свойствами, свидетельствующими о наличии четырех неспаренных электронов, а цианидный ([Fe(CN)6]4–) – диамагнитен, т.е. неспаренных электронов не имеет; в аналогичных комплексах Fe3+([FeF6]3–и [Fe(CN)6]3–) обнаруживаются пять и один неспаренный электрон, соответственно.
В рамках данной простой электростатической модели не было никаких идейных подходов даже для качественного объяснения окрашенности комплексов, часто наблюдаемого изменения окраски даже при минимальном изменении состава внутренней сферы:
| [Co(NH3)6]3+– желтый | [Co(NH3)6]3+– желтый |
| [Co(NH3)5Cl]2+– пурпурнокрасный | [Co(NH3)5NCS]2+– оранжевый |
| транс-[Co(NH3)4Cl2]+– красный | [Co(NH3)5ОН2]2+– красный |
| цис-[Co(NH3)4Cl2]+– фиолетовый | [Co(NH3)5ОН]2+– розовый |
Дата добавления: 2014-11-13; просмотров: 796; Мы поможем в написании вашей работы!; Нарушение авторских прав |