
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергетика процессов
Энергетический эффект химического процесса возникает за счет изменения в системе внутренней энергии U или энтальпии H. Внутренней энергией системы называют энергию всех видов движения и взаимодействия тел или частиц, составляющих систему (кинетическая энергия межмолекулярного взаимодействия, вращательная энергия, колебательное движение атомов и групп в молекуле, энергия взаимодействия электронов между собой и с ядрами). Для химических реакций под работой против внешних сил в основном подразумевается работа против внешнего давления. В первом приближении (при p = const) она равна произведению давления р на изменение объема системы DV при переходе ее из состояния 1 в состояние 2:  если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты qv связано с изменением внутренней энергии системы.
если химическая реакция протекает при постоянном объеме, то выделение или поглощение теплоты qv связано с изменением внутренней энергии системы.
Величину Н называют энтальпией. Энтальпию можно рассматривать как энергию расширенной системы. Наибольшую теплоту, которую можно получить при химическом процессе при данной температуре, называют тепловым эффектом процесса. Процессы в химии, при которых теплота выделяется, называются экзотермическими, а процессы, при которых теплота поглощается, - эндотермическими.Тепловые эффекты экзотермических реакций в термохимии принято считать положительными, а эндотермических функций – отрицательными.
Q = -q, т.е. QV = -DU; QP = -DH.
2. Температура, внутренняя энергия, теплота, работа (термодинамическая интерпретация)
Внутренняя энергия U представляет собой сумму четырех слагаемых, каждое из которых характеризует определенный вид движения в системе: кинетическую энергию движения (поступательного, вращательного, колебательного) структурных частиц (Eк), потенциальную энергию межмолекулярного взаимодействия (Еп), химическую энергию внутримолекулярной химической связи (Ех), атомную энергию взаимодействия нуклонов в ядрах (Еа):
U = Eк + Еп + Ех + Еа; ∆U = U2 - U1 = ∆Eк +∆Еп +∆Еx (формула внутренней энергии в кнечных продуктах реакции) Теплота — результат изменения внутренней энергии, характеризующий передачу хаотического поступательного, колебательного и вращательного движения от структурных частиц системы к частицам внешней среды (или наоборот) путем теплопроводности, излучения или конвекции. Такую передачу энергии называют теплопередачей. Количественно изменение внутренней энергии в процессе теплопередачи оценивают количеством переданной теплоты q. Температура представляет собой термодинамический параметр, характеризующий энергетическое состояние частиц, вещества или системы. Температура относится к интенсивным свойствам, она не следует закону аддитивности. Нельзя, слив в один стакан несколько пробирок воды с одинаковой температурой, получить воду с более высокой температурой. Число, которым характеризуют температуру, надо рассматривать как единое целое: 1000С не является суммой ста единичных градусов Цельсия. Работа — результат изменения внутренней энергии, характеризующий передачу упорядоченного поступательного движения от организованного потока частиц системы к частицам внешней среды (или наоборот) с созданием в ней такого же организованного, поступательно движущегося потока частиц. Количество совершенной в этом процессе работы A определяет изменение внутренней энергии. В химических реакциях обычно изменяется объем газообразных реагентов и продуктов реакции и совершается работа расширения или сжатия системы. Работа расширения или сжатия при постоянном внешнем давлении окружающей среды (р = const) равна: Ам = р(V2 —V1)= p∆V, где Ам — механическая работа; V1 и V2 — объемы системы соответственно после окончания и до начала химической реакции.
3.Первый закон термодинамики, его смысл, математическое выражение 
 математическое выражение (1 закон термодемики) закон сохранения энергии (который называется также первым законом термодинамики), т.е. означает что сумма изменения внутренней энергии и совершенной системой (или над нею) работы равна сообщенной (или выделенной ею) теплоте. Оющий смысл закона: представляет собой закон сохранения энергии для термодинамических систем.
математическое выражение (1 закон термодемики) закон сохранения энергии (который называется также первым законом термодинамики), т.е. означает что сумма изменения внутренней энергии и совершенной системой (или над нею) работы равна сообщенной (или выделенной ею) теплоте. Оющий смысл закона: представляет собой закон сохранения энергии для термодинамических систем.
4.Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.  .
. 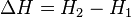 (в процессе изменения состояния). Изменение энтальпии (или Тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда
(в процессе изменения состояния). Изменение энтальпии (или Тепловой эффект химической реакции) не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра, являющегося функцией состояния, равно нулю, отсюда  , или же
, или же
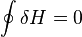 энтальпия образования — количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ. Энтальпия — величина аддитивная (экстенсивная), т. е. для сложной системы равна сумме энтальпий её независимых частей
энтальпия образования — количество энергии, которое выделяется или поглощается при образовании сложного вещества из простых веществ. Энтальпия — величина аддитивная (экстенсивная), т. е. для сложной системы равна сумме энтальпий её независимых частей  . Подобно другим термодинамическим потенциалам, энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна
. Подобно другим термодинамическим потенциалам, энтальпия определяется с точностью до постоянного слагаемого, которому в термодинамике часто придают произвольные значения (например, при расчете и построении тепловых диаграмм). При наличии немеханических сил величина энтальпии системы равна
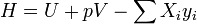
где  — обобщённая сила;
— обобщённая сила;  — обобщённая координата.
— обобщённая координата.
5. Экспериментальное определение тепловых эффектов процессов. Как известно, каждое физико-химическое превращение вещества сопровождается превращением энергии. Для сопоставления изменения энергии при различных реакциях в термодинамике используются понятие теплового эффекта, т. е. количества теплоты, которое выделяется или поглощается в химическом процессе при условии равенства начальной и конечной температуры. Тепловой эффект обычно относят к молю реагирующего вещества и выражают в джоулях. Тепловые эффекты отличаются друг от друга, если процессы происходят в закрытом сосуде (при постоянном объеме V=const) или в открытом сосуде (при постоянном давлении P=const). Тепловой эффект при постоянном объеме равен убыли внутренней энергии: QVT= –∆UT, а при постоянном давлении – убыли энтальпии: QРT= –∆НT Тепловой эффект не зависит от промежуточных стадий, а определяется лишь начальным и конечным состоянием системы при условии, что единственной работой, совершаемой системой, является работа против внешнего давления и что давление или объем в течении всего процесса остаются неизменными (закон Гесса). С помощью закона Гесса производят различные термохимические расчеты. Определение тепловых эффектов производят в специальных приборах, называемых калориметрами. В зависимости от характера процесса и реагирующих веществ применяют калориметры различных конструкций, но все калориметры содержат калориметрический сосуд, который защищается от потерь тепла и снабжен чувствительным ртутным тепломером или другим устройством для измерения температуры.
6.Термохи́мия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов. Основные понятия и законы термохимии:Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции. В термохимии также используют уравнения, в которых тепловой эффект относят к одному молю образовавшегося вещества, применяя в случае необходимости дробные коэффициенты.
Тепловой эффект химической реакции равен разности между суммарной энтальпией образования всех продуктов реакции и всех исходных веществ, с учетом стехиометрических коэффициентов (количества молей прореагировавших веществ). То есть, тепловой эффект химической реакции рассчитывается по общему выражению:
ΔH=(∑ΔHпродуктов)-(∑ΔHисходных)
Таким образом, чем устойчивее продукты реакции и чем выше внутренняя энергия исходных соединений, тем выше тепловой эффект реакции, что является прямым следствием из закона минимума энергии и максимума энтропии. Для расчетов тепловых эффектов реакций в стандартных условиях используют стандартные энтальпии образования соединений, взятые из справочных таблиц.
7.Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.
8.Закон Гесса — основной закон термохимии, который формулируется следующим образом:
· Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данноехимическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
Типы процессов и стандартные термохимические величины. Зависимость теплового эффекта от температуры. Любое изменение одного или нескольких параметров системы называют термодинамическим процессом.
Повышение температуры, в свою очередь, вызовет изменение внутренней энергии системы (U),которая состоит из кинетической и потенциальной энергий составляющих ее частиц (молекул, электронов, нуклонов).
Внутренняя кинетическая энергия обусловлена тепловым хаотическим движением молекул, что непосредственно связано с температурой – с увеличением температуры тела интенсивность этого движения возрастает.
Внутренняя потенциальная энергия обусловлена взаимодействием частиц друг с другом (взаимное отталкивание или притяжение).
Cv и Cp- это моляргая теплоемкость при постоянных С и V.
DH=CpDT; DU=CvDT
Cp- тепло ,которое нужно сообщить 1 молю, чтобы его нагреть на 1 градус. Чтобы рассчитать тепловой эффект dH=CpdT. Эта формула справедлива, если при нагреве не происходит изменения агрегатного состояния тела. Если происходит, то нужно учесть, что тепловой эффект фазового перехода (+DH ф.п) Фазовое превращение –изобарно-изотермического превращения (Т,Р=const) Плавление - кристаллизация, испарение-конденсация.
10. Теплоемкость. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяемая отношением бесконечно малогоколичества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT[1]:  Единица измерения теплоёмкости в Международной системе единиц (СИ) — Дж/К.
Единица измерения теплоёмкости в Международной системе единиц (СИ) — Дж/К.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая удельная теплоёмкость (С), также называемая просто удельной теплоёмкостью — это количество теплоты, которое необходимо подвести к единице массывещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1).
Объёмная теплоёмкость (С′) — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1).
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж/(моль·К)). Это не обязательно: Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Для примера, в молекулярно-кинетической теории газов показывается, что молярная теплоёмкость идеального газа с i степенями свободы при постоянном объёме (для одного моля идеального газа) равна:  где R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
где R ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная.
11. Энтропия, её термодинамический и статистический смысл.
Термодинамическая энтропия S, часто просто именуемая энтропия, — физическая величина, используемая для описаниятермодинамической системы, одна из основных термодинамических величин. Энтропия является функцией состояния и широко используется в термодинамике, в том числе химической. Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла  к величине абсолютной температуры
к величине абсолютной температуры  :
:  .
.
12. Второй закон термодинамики. Если исходить из первого закона термодинамики, то можно допустить протекание любого процесса, который не противоречит закону сохранения энергии. В частности, при теплообмене можно было бы предположить, что теплота может передаваться как от тела с большей температурой к телу с меньшей температурой, так и наоборот. При этом согласно первому закону термодинамики накладывается только одно условие: чтобы количество теплоты, отданной одним телом, равнялось количеству теплоты, принятой другим телом.
Между тем, из опыта известно, что теплота всегда самопроизвольно передается только от более нагретых тел к менее нагретым. Самопроизвольный или естественный процесс теплообмена обладает свойством направленности в сторону тел с более низкой температурой. Причём он прекращается при достижении равенства температур участвующих в теплообмене тел. Однако, возможен и обратный, не самопроизвольный (или противоестественный) процесс передачи теплоты от менее нагретых тел к более нагретым (например, в холодильных установках), но для осуществления его требуется подвод энергии извне как бы для компенсации протекания процесса.
Констатация этой особенности теплоты, проявляющейся в процессе ее передачи, является одной из сторон сущности второго закона термодинамики, который Р. Клаузиус (1850 г.) сформулировал так: теплота не может сама собой переходить от менее нагретого тела к более нагретому, т. е. некомпенсированный переход теплоты от тела с меньшей температурой невозможен.
Еще одна особенность теплоты наиболее ярко раскрывается при рассмотрении процесса преобразования ее в работу. Опыт показывает, что работа может быть полностью превращена в теплоту (например, посредством трения) без каких-либо дополнительных условий или компенсации. Обратное же превращение теплоты в работу требует дополнительного самопроизвольного процесса или компенсации.
Второй закон термодинамики устанавливает направленность и условия протекания естественных процессов. Так же, как и первый закон термодинамики, он был выведен на основании экспериментальных данных.
Опыт показывает, что превращение теплоты в полезную работу в тепловых двигателях может происходить только при переходе теплоты от нагретого тела к холодному, то есть при наличии разности температур между теплоотдатчиком (нагревателем) и теплоприемником (холодильником). При этом вся теплота не может быть превращена в работу.
Устройство, которое без компенсации полностью превращало бы в работу теплоту какого-либо источника, называется вечным двигателем второго рода.
Таким образом, второй закон термодинамики утверждает, что создание вечного двигателя второго рода невозможно.
Открытие второго закона термодинамики связано с анализом работы тепловых машин. Впервые сущность этого закона изложил в 1824 г. французский инженер С. Карно в работе «Размышление о движущей силе огня и машин, способных развивать эти силы». С. Карно впервые указал на возможность превращения теплоты в полезную работу в двигателях лишь при наличии двух источников теплоты: одного с более высокой температурой (нагреватель с температурой T2) и другого с меньшей температурой (холодильник с температурой T1).
Позднее Р. Клаузиус и В. Томсон (Кельвин) дали наиболее общие формулировки второго закона термодинамики, из которых следует, что:
1. Невозможен процесс, при котором теплота переходила бы самопроизвольно от холодных тел к телам нагретым.
2. Не вся теплота, полученная от теплоотдатчика, может перейти в работу, а только часть ее. Часть теплоты должна перейти в теплоприемник.
Дата добавления: 2015-01-29; просмотров: 586; Мы поможем в написании вашей работы!; Нарушение авторских прав |