
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Направление процессов
3.1.5. Энергия Гиббса, направленность процессов
Самопроизвольное протекание химических процессов определяется двумя факторами:
– стремлением к образованию прочных связей между частицами, более сложных веществ, сопровождающимся уменьшением внутренней энергии системы. Эта тенденция в изобарно-изотермических условиях характеризуется энтальпийным (энергетическим) фактором и количественно выражается: 
– стремлением к разъединению частиц, к беспорядку, характеризуемым возрастанием энтропии. Тенденция количественно выражается:  (с учетом абсолютной температуры процесса –
(с учетом абсолютной температуры процесса –  ).
).
Для изобарно-изотермического процесса оба фактора самопроизвольного протекания реакции объединяет функция:  – энергия Гиббса (изобарно-изотермический потенциал или свободная энергия системы).
– энергия Гиббса (изобарно-изотермический потенциал или свободная энергия системы).
Формула Гиббса:  . (32)
. (32)
Если система переходит из одного состояния в другое, то:
 (33)
(33)
Формула (33) представляет математическое выражение второго закона термодинамики (см. п. 3.1.4). Зависимостью 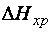 и
и  от температуры в расчетах часто пренебрегают.
от температуры в расчетах часто пренебрегают.
Уравнение (33) можно записать в виде:
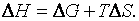 (34)
(34)
Согласно формуле (34) энтальпия химической реакции  включает две составляющие: энергию Гиббса
включает две составляющие: энергию Гиббса  , т. е. часть энергетического эффекта процесса, которую можно превратить в работу (свободная энергия системы), и энтропийную составляющую
, т. е. часть энергетического эффекта процесса, которую можно превратить в работу (свободная энергия системы), и энтропийную составляющую 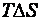 – часть энергетического эффекта, которая не превращается в работу, а рассеивается в окружающую среду в виде теплоты (связанная энергия системы).
– часть энергетического эффекта, которая не превращается в работу, а рассеивается в окружающую среду в виде теплоты (связанная энергия системы).
Следовательно, изменение свободной энергии системы  – это общая движущая сила химического. процесса, протекающего в изобарно-изотермических условиях, учитывающая влияние на процесс как энтальпийного, так и энтропийного фактора.
– это общая движущая сила химического. процесса, протекающего в изобарно-изотермических условиях, учитывающая влияние на процесс как энтальпийного, так и энтропийного фактора.
Энергия Гиббса  – это критерий самопроизвольного протекания химической реакции:
– это критерий самопроизвольного протекания химической реакции:
–  < 0 – условие самопроизвольного протекания процесса в прямом направлении;
< 0 – условие самопроизвольного протекания процесса в прямом направлении;
–  > 0 – процесс при данных условиях невозможен;
> 0 – процесс при данных условиях невозможен;
–  = 0 – состояние химического равновесия.
= 0 – состояние химического равновесия.
Частные случаи протекания процесса:
1) химические реакции протекают при низких температурах, тогда | 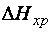 | >> |
| >> |  |,
|, 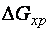 ≈
≈ 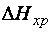 . Следовательно, при низких температурах критерием направления процесса является тепловой эффект реакции. Самопроизвольно протекают экзотермические процессы, сопровождающиеся уменьшением внутренней энергии системы (
. Следовательно, при низких температурах критерием направления процесса является тепловой эффект реакции. Самопроизвольно протекают экзотермические процессы, сопровождающиеся уменьшением внутренней энергии системы (  < 0) и уменьшением энтальпии системы (
< 0) и уменьшением энтальпии системы ( 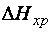 < 0),
< 0), 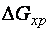 < 0;
< 0;
2) химические реакции протекают при высоких температурах, тогда | 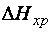 | << |
| << |  |,
|, 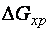 ≈ –
≈ –  . Следовательно, при высоких температурах критерием направления процесса является знак изменения энтропии процесса. Самопроизвольно протекают процессы в сторону возрастания энтропии:
. Следовательно, при высоких температурах критерием направления процесса является знак изменения энтропии процесса. Самопроизвольно протекают процессы в сторону возрастания энтропии:  > 0,
> 0, 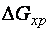 < 0;
< 0;
3) при некоторой температуре | 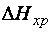 | ≈ |
| ≈ |  |,
|, 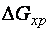 = 0, система находится в состоянии химического равновесия.
= 0, система находится в состоянии химического равновесия.
В случае если процесс протекает в стандартных условиях,  можно рассчитать по следствию из закона Гесса:
можно рассчитать по следствию из закона Гесса:
 (35)
(35)
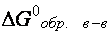 , [кДж/моль], определяют по таблице термодинамических констант (см. приложение, табл. 6).
, [кДж/моль], определяют по таблице термодинамических констант (см. приложение, табл. 6).  = 0.
= 0.
20)Самопроизвольные процессы
Дата добавления: 2015-01-29; просмотров: 378; Мы поможем в написании вашей работы!; Нарушение авторских прав |