
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
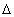 S =
S =  S(прод.) –
S(прод.) –  S(исх.),
S(исх.),
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак 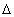 S реакции можно оценить по изменению объема системы
S реакции можно оценить по изменению объема системы 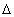 V в результате процесса. Знак
V в результате процесса. Знак 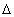 V определяется по изменению количества вещества газообразных реагентов
V определяется по изменению количества вещества газообразных реагентов 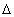 nг. Так, для реакции CaCO3(к) = CaO(к) + CO2(г):
nг. Так, для реакции CaCO3(к) = CaO(к) + CO2(г):
( 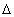 nг = 1)
nг = 1) 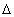 V > 0, значит,
V > 0, значит, 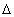 S > 0.
S > 0.
Для реакции С(графит) + 2Н2(г) = СН4(г)
( nг = -1) 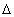 V 0, следовательно и
V 0, следовательно и 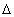 S 0.
S 0.
Дата добавления: 2015-01-29; просмотров: 366; Мы поможем в написании вашей работы!; Нарушение авторских прав |