
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярные силы
Множество опытных фактов приводят к заключению, что между молекулами вещества, находящемся в любом агрегатном состоянии, действуют одновременно как силы притяжения, так и силы отталкивания. Так, например, способность твердых тел оказывать сопротивление растяжению свидетельствует о наличии сил притяжения между молекулами; существование же сил отталкивания объясняет малую сжимаемость твердых и жидких тел, а также сильно уплотненных газов. Очень важно, что эти силы должны действовать одновременно. В противном случае тело не было бы устойчиво: образующие его молекулы разлетались бы в разные стороны (при наличии только сил отталкивания), создавая вещества сверхнизкой плотности, или слипались бы в сверхплотные агрегаты (при существовании только сил притяжения).
Силы, действующие между молекулами, по своей природе являются силами электромагнитного происхождения. Молекула состоит из положительно заряженных ядер атомов, составляющих молекулу, и отрицательно заряженных электронных оболочек атомов. Поэтому при взаимодействии молекул одновременно действуют как силы притяжения их разноименных зарядов, так и силы отталкивания одноименных. И те, и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания должно быть более быстрым, чем сил притяжения, в результате чего силы отталкивания будут преобладать на малых расстояниях между молекулами, а силы притяжения – на более дальних расстояниях. Последнее утверждение следует из необходимости существования устойчивого равновесия взаимодействующих молекул. В самом деле, предположим, что две взаимодействующие молекулы находятся в равновесии, т. е. сумма сил, действующих на каждую молекулу равна нулю.

Р и с. 1
Абсолютная величина сил взаимодействия существенно зависит от конкретного строения молекул. Кроме того, для несферических молекул силы электрического взаимодействия зависят, очевидно, не только от расстояния между молекулами, но и от взаимной ориентации молекул.
Р и с. 2
 Однако общий характер зависимости силы взаимодействия от расстояния одинаков: преобладание сил притяжения на больших расстояниях и отталкивания на малых.
Однако общий характер зависимости силы взаимодействия от расстояния одинаков: преобладание сил притяжения на больших расстояниях и отталкивания на малых.
На рис. 2 приведены характерные зависимости сил отталкивания, которые в физике положительны (F1 > 0), и сил притяжения (F2 < 0) от расстояния r между молекулами. Эти силы действуют одновременно.
Результирующая функция F = F1+ F2представлена на том же рисунке сплошной линией. Как видно, на расстояниях r<r0 между молекулами преобладают силы отталкивания, а при r > r0 превалируют силы притяжения. При r = r0 эти силы равны, т. е. r0 – это то равновесное расстояние между молекулами, на котором они находились бы при отсутствии теплового движения, нарушающего это равновесие.
В молекулярной физике оперируют не с силами, а с потенциальными энергиями взаимодействий. Чтобы осуществить переход от сил к потенциальным энергиям, рассмотрим работу, совершаемую результирующей силой F при изменении расстояния между молекулами на dr:
dA = Fdr. (11)
Эта работа совершается за счет уменьшения потенциальной энергии взаимодействия молекул:
dA = – dEp. (12)
Из выражений (11) и (12)
dEp = – Fdr. (13)
или 
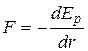 . (14)
. (14)
Интегрируя соотношение (13) по r от r до бесконечности, получим 
Потенциальную энергию полагают равной нулю при бесконечно большом расстоянии между молекулами, т. е.  Тогда
Тогда
 (15)
(15)
 Из последнего соотношения видно, что потенциальная энергия Ep(r)взаимодействия молекул, находящихся на расстоянии r друг от друга, численно равна площади, ограниченной кривой результирующей силы F(r), осью r и вертикальной прямой r = const. Зависимость величины этой площади (т. е. Ep(r)) от r показана на рис. 3.
Из последнего соотношения видно, что потенциальная энергия Ep(r)взаимодействия молекул, находящихся на расстоянии r друг от друга, численно равна площади, ограниченной кривой результирующей силы F(r), осью r и вертикальной прямой r = const. Зависимость величины этой площади (т. е. Ep(r)) от r показана на рис. 3.
Из рис. 3 видно, что при перемещении некоторой молекулы 1 из бесконечности к молекуле 2, которая расположена в начале координат, потенциальная энергия их взаимодействия убывает от нуля до  .
.
Р и с. 3
Для иллюстрации на рис. 4 приведены кривые потенциальных энергий взаимодействия одноатомных молекул гелия и также молекул аргона. (На рис. 4 расстояния указаны в ангстремах  )
)

Р и с. 4
На рис. 4 отражено известное общее правило: с ростом размеров молекулы молекулярные силовые связи возрастают. Это объясняет, к примеру, факт плавления твердого аргона при температуре 84 К, которая значительно выше, чем температура плавления твердого гелия (1,75 К).
Таким образом, из самых общих соображений установлены характерные свойства взаимодействия молекул.
Силы взаимодействия между молекулами принято называть ван-дер-ваальсовыми по имени нидерландского физика Ван-дер-Ваальса, впервые изучавшего их.
Формула для потенциальной энергии взаимодействия молекул (потенциал Леннарда – Джонса):
 , (16)
, (16)
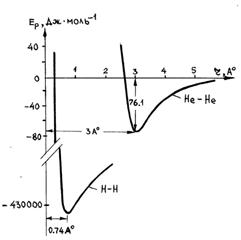 где А и В – положительные постоянные, зависящие от рода молекул и определяемые из экспериментальных данных по отклонению свойств реальных газов от свойств идеального газа. Величина показателя степени зависит от структуры молекулы и находится в пределах 8 ≤ n ≤ 15. Первый член в формуле (16) соответствует силам отталкивания, второй – силам притяжения Ван-дер-Ваальса. Силы притяжения, хотя и медленнее, чем силы отталкивания убывают с ростом r, но, как показывают расчеты, и они на расстояниях ρ > 10 – 9 м между молекулами оказываются пренебрежимо малыми. Поэтому сферу с радиусом ρ ≈ 10 – 9 м называют сферой молекулярного действия сил. На расстояниях ρ > 10 – 9 м силу взаимодействия между молекулами полагают равной нулю. Очень важно отметить, что ван-дер-ваальсово взаимодействие молекул существенным образом отличается от так называемого химического взаимодействия атомов, приводящего к образованию молекул. Огромное различие этих взаимодействий проиллюстрировано на рис. 5. На нем приведены кривые потенциальных энергий взаимодействий двух атомов гелия (химически инертных) и двух атомов водорода, образующих в результате химического взаимодействия молекулу Н2.
где А и В – положительные постоянные, зависящие от рода молекул и определяемые из экспериментальных данных по отклонению свойств реальных газов от свойств идеального газа. Величина показателя степени зависит от структуры молекулы и находится в пределах 8 ≤ n ≤ 15. Первый член в формуле (16) соответствует силам отталкивания, второй – силам притяжения Ван-дер-Ваальса. Силы притяжения, хотя и медленнее, чем силы отталкивания убывают с ростом r, но, как показывают расчеты, и они на расстояниях ρ > 10 – 9 м между молекулами оказываются пренебрежимо малыми. Поэтому сферу с радиусом ρ ≈ 10 – 9 м называют сферой молекулярного действия сил. На расстояниях ρ > 10 – 9 м силу взаимодействия между молекулами полагают равной нулю. Очень важно отметить, что ван-дер-ваальсово взаимодействие молекул существенным образом отличается от так называемого химического взаимодействия атомов, приводящего к образованию молекул. Огромное различие этих взаимодействий проиллюстрировано на рис. 5. На нем приведены кривые потенциальных энергий взаимодействий двух атомов гелия (химически инертных) и двух атомов водорода, образующих в результате химического взаимодействия молекулу Н2.
Дата добавления: 2015-04-18; просмотров: 685; Мы поможем в написании вашей работы!; Нарушение авторских прав |