
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение. Число N молекул, содержащихся в некоторой системе массой m, равна произведению постоянной Авогадро NА на количество вещества v: N=vNA
Число N молекул, содержащихся в некоторой системе массой m, равна произведению постоянной Авогадро NА на количество вещества v: N=vNA
Так как v= m/М, где М – молярная масса, N =  . Выразив в этой формуле массу как произведение плотности на объем V, получим: N=ρVNA/M.
. Выразив в этой формуле массу как произведение плотности на объем V, получим: N=ρVNA/M.
Произведем вычисления, учитывая, что М= 18*10-3 кг/моль (см. приложение 14):
N =  *6,02*1023 молекул = 3,34*1019 молекул.
*6,02*1023 молекул = 3,34*1019 молекул.
Массу m1 одной молекулы можно найти по формуле: m1 = М/ NА. (1).
Подставив в (1) значения М и NА, найдем массу молекулы воды:
m1 =  кг = 2,99*10-26кг.
кг = 2,99*10-26кг.
Если молекулы воды плотно прилегают друг к другу, то можно считать , что на каждую молекулу приходится объем (кубическая ячейка) V1=d3, где d – диаметр молекулы. Отсюда: d = 
 (2)
(2)
Объем V1 найдем, разделив молярный объем Vm на число молекул в моле, т.е. на NА:
V1 = Vm/ NА. (3)
Подставим выражение (3) в (2):
d =  ,
,
где Vm = М/ρ. Тогда: d = 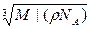 (4)
(4)
Проверим, дает ли правая часть выражения (4) единицу длины:
 = 1 м.
= 1 м.
Произведем вычисления:
d= 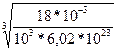 м = 3,11*10-10м = 311пм.
м = 3,11*10-10м = 311пм.
Пример 4.
В баллоне объемом 10л находится гелий под давлением р1 = 1Мпа и при температуре Т1 = 300К. После того как из болона было взято m = 10г гелия, температура в болоне понизилась до Т2 = 290К. Определить давление р2 гелия, оставшегося в болоне.
Решение.
Для решения задачи воспользуемся уравнением Менделеева – Клайперона, применив его к конечному состоянию газа:
р2V =  RT2. (1)
RT2. (1)
где m2 – масса гелия в баллоне в конечном состоянии; М- молярная масса гелия; R- молярная газовая постоянная.
Из уравнения (1) выразим искомое давление:
р2= mRT2/(MV). (2)
массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона: m2 = m1 – m. (3)
Массу m1 гелия найдем также из уравнения Менделеева- Клапейрона, применив его к начальному состоянию: m1 = Мр1V/(RT1) (4)
Подставив выражения массы m1 в (3), а затем выражение m2 в (2), найдем:
р2 =  .
.
или
Р2 =  р1 -
р1 -  . (5)
. (5)
Проверим. дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (Т2/Т1) –безразмерный, а второй – давление. Проверим второе слагаемое:

 =
=  =
=  =1Па.
=1Па.
Паскаль является единицей давления. Произведем вычисления по формуле (5), учитывая, что М = 4*10-3 кг/моль (см. приложение 14) :
р2 =  Па =3,64*105 Па = 0,364 Мпа.
Па =3,64*105 Па = 0,364 Мпа.
Дата добавления: 2015-02-10; просмотров: 373; Мы поможем в написании вашей работы!; Нарушение авторских прав |